
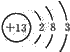 ;
; 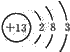 ;原子晶体;
;原子晶体;| 21.4g |
| 107g/mol |
| (36.0-11.0-16.0)g |
| 36.0g |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
| A、配制FeCl3溶液,为了抑制水解,常加盐酸 |
| B、盐类都能水解 |
| C、盐类水解通常都是吸热的 |
| D、水解达到平衡时的AlCl3稀溶液中,无论再加入饱和AlCl3溶液还是加水或者加热,其水解平衡均向正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、CO32-、K+、Na+ |
| B、Na+、Ba2+、Cl-、HCO3- |
| C、NO3-、Cu2+、K+、SO42- |
| D、NO3-、K+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
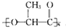 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )| A、聚乳酸是一种纯净物 |
B、聚乳酸的单体是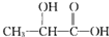 |
| C、聚乳酸是一种羧酸 |
| D、聚乳酸是由其单体通过加聚反应合成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com