
如图中,A、B、C、D、E是单质,F、G、H、I是B、C、D、E分别和A形成的化合物。已知:①G、H的化学式为“X2Y3”形式,F的化学式为“XY”形式;②I是一种常见的气体,能使澄清石灰水变浑浊,固态I用于人工降雨, E可以在I中燃烧,发生置换反应;③F中的A元素的质量分数为40%。回答问题:

(1)I和E反应的化学方程式为: 。(2分)
(2)C既能与盐酸反应,又能与氢氧化钠溶液反应。C和A形成的化合物H与氢氧化钠溶液反应的离子方程式为: 。(2分)电解H可以制取C, 反应的化学方程式为: 。(2分)
(3)G是一种红棕色粉末,向一定量的G中加入足量硫酸,反应的化学方程式为: 。(2分)向反应后的溶液中加入足量铁粉,反应的离子方程式为: 。(2分)
(4)G与盐酸反应的离子方程式为: 。(2分)得到的溶液中加入铜粉,反应的离子方程式为: 。(2分)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需铜粉 g(3分)。
(1)2Mg+CO2 2MgO+C(2分)(2)Al2O3+2OH-=2AlO2-+H2O(2分)
2MgO+C(2分)(2)Al2O3+2OH-=2AlO2-+H2O(2分)
2Al2O3 4Al+3O2↑(2分)
4Al+3O2↑(2分)
(3)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O(2分)2Fe3++Fe=3Fe2+(2分)
(4)Fe2O3+6H+=2Fe3++3H2O(2分) Cu+2Fe3+=Cu2++2Fe2+(2分) 0.64g(1分)
解析试题分析:I是一种常见的气体,能使澄清石灰水变浑浊,固态I用于人工降雨,这说明I是二氧化碳。E可以在I中燃烧,发生置换反应2E+I=2F+D,推断E为金属单质Mg,发生的反应为,2Mg+CO2 2MgO+C,F为MgO,D为单质C;MgO中的氧元素的质量分数为40%,证明推断正确.因此E是镁,则A是氧气,D是碳,F是氧化镁。
2MgO+C,F为MgO,D为单质C;MgO中的氧元素的质量分数为40%,证明推断正确.因此E是镁,则A是氧气,D是碳,F是氧化镁。
(1)I和E反应的化学方程式为2Mg+CO2 2MgO+C。
2MgO+C。
(2)C既能与盐酸反应,又能与氢氧化钠溶液反应,说明C是金属铝。C和A形成的化合物H是氧化铝,属于两性氧化物与氢氧化钠溶液反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;电解氧化铝可以制取铝, 反应的化学方程式为2Al2O3 4Al+3O2↑。
4Al+3O2↑。
(3)G是一种红棕色粉末,则G是氧化铁。向一定量的G中加入足量硫酸,反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;铁离子能氧化单质铁,因此向反应后的溶液中加入足量铁粉,反应的离子方程式为2Fe3++Fe=3Fe2+。
(4)氧化铁与盐酸反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O;铁离子能氧化单质铜,因此得到的溶液中加入铜粉,反应的离子方程式为Cu+2Fe3+=Cu2++2Fe2+;1.6g 氧化铁的物质的量是1.6g÷160g/mol=0.01mol,根据方程式Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=Cu2++2Fe2+可知 Fe2O3~Cu,则需要铜的物质的量是0.01mol,铜粉的质量是0.64g。
考点:考查无机物推断


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
A~G各物质间的关系如下图所示,其中B、D为气体单质。则下列说法错误的是
A.若反应①在常温下进行,则1 mol A在反应中能转移1 mol电子
B.反应②的离子方程式为MnO2+4H++2Cl- Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
C.新配制的F溶液一般需要加入铁屑和稀盐酸,前者用于防止Fe2+被空气氧化成Fe3+,后者可抑制Fe2+的水解
D.已知C的浓溶液在催化剂存在的条件下加热,能与B反应生成D,由此可以推断B的氧化性比MnO2强
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分).巳知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol 丁分子中不同原子的数目比为1 :2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件巳略去)。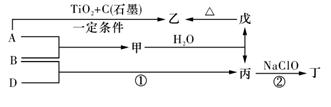
请回答:(1)单质B的组成元素在周期表中的位置是_________。
(2)戊的化学式为________。戊与强碱反应的离子方程式:________________
(3)丙中所包含的化学键类型有________ (填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应①的化学方程式为________________________。
(5)反应②中,0.5mol NaClO参加反应时,转移1 mol电子,其化学方程式为_________
(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。巳知,该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
中学化学中的一些常见物质有下图转化关系(部分产物未给出)。其中A的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属。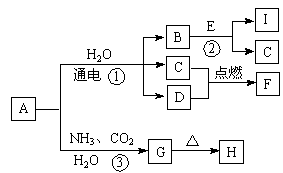
回答下列问题。
(1)F的电子式为 。
(2)G的化学式为 。
(3)写出反应①的化学方程式 。
(4)写出反应②的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A~H均为短周期元素,A~F在元素周期表中的相对位置如图1所示,G与其它七种元素
| 图1 | |||
| A | B | C | |
| D | | E | F |
| 图2 | |||
 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
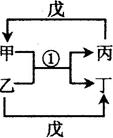
在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,I为一常见金属,酸G是重要的化工产品和化工原料;固体H能够溶解在A溶液和酸G中,且H为良好的耐火材料(图中部分产物没有列出)。
(1)固体甲与液体M反应的方程式为______。A溶液与固体H反应的离子方程式为______。
(2)固体乙的化学式为_______。液体M的电子式为_______。
(3)反应①~⑦中属于氧化还原反应的为_______(填写反应序号)。
(4)若I与C的稀溶液不反应,只能与G的浓溶液在加热条件下反应,则反应⑦的化学方程式为_______。
(5)若由黄铁矿(FeS2)与气体B反应来生产气体E,且每生成1 mol E放出426.5 kJ的热量,该反应的热化学方程式为_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
提示:4FeS2+11O2高温,2Fe2O3+8SO2
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第________周期________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为________。
(3)在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是________(填序号)。
(4)反应④的离子方程式是_____________________________________。
(5)将化合物D与KNO3、KOH共熔,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂,F是地壳中含量最多的金属元素。(反应中生成的水和部分反应条件未列出)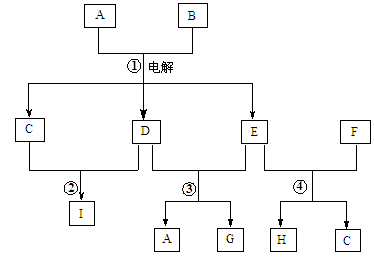
(1)画出A中阴离子的结构示意图 。
(2)反应②在点燃条件下的现象是 。
(3)H转化为F的氢氧化物最好选择的试剂是 。
(4)反应③的离子方程式为 。
(5)反应④的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F都是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1 mol·L-1 D溶液的pH为13(25 ℃)。它们满足如图转化关系,则下列说法正确的是( )。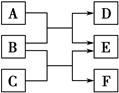
A.原子半径W>Z>Y>X
B.0.1 mol·L-1 F溶液中阴离子总的物质的量大于0.1 mol·L-1 D溶液中阴离子总的物质的量
C.0.1 mol B与足量C完全反应共转移电子数0.1NA
D.Z元素的最高正价为+6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com