

分析 A、B、C、D、E、F为元素周期表中前四周期且原子序数依次增大的六种元素.A、B、C、D核电荷数之和为36,则B不能位于第三周期,由于第三周期中Na、Mg、Al三者原子序数之和最小为36,A、C原子的最外层电子数之和等于B原子的次外层电子数,则B处于第二周期,A、C原子最外层电子数均为1,二者处于IA族,C、D不可能处于第三周期,因为第四周期中K、Ca二者原子序数之和最小为39,故C也属于短周期元素,C的原子序数又大于B,故C为Na,A为氢或锂,A、B、D原子序数之和为36-11=25,D原子质子数为B原子质子的两倍,则A为H元素、B为O元素、D为S元素;E元素所在主族均为金属,则E处于ⅡA族,原子序数大于硫,故E为Ca.
解答 解:A、B、C、D、E、F为元素周期表中前四周期且原子序数依次增大的六种元素.A、B、C、D核电荷数之和为36,则B不能位于第三周期,由于第三周期中Na、Mg、Al三者原子序数之和最小为36,A、C原子的最外层电子数之和等于B原子的次外层电子数,则B处于第二周期,A、C原子最外层电子数均为1,二者处于IA族,C、D不可能处于第三周期,因为第四周期中K、Ca二者原子序数之和最小为39,故C也属于短周期元素,C的原子序数又大于B,故C为Na,A为氢或锂,A、B、D原子序数之和为36-11=25,D原子质子数为B原子质子的两倍,则A为H元素、B为O元素、D为S元素;E元素所在主族均为金属,则E处于ⅡA族,原子序数大于硫,故E为Ca.
(1)a.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:C(Na)>D(S)>B(O),故a错误;
b.E为Ca、F为Cu,二者最外层电子数分别为2、1,故b错误;
c.H、O、Na、S四种元素中电负性和第一电离能最大的均为O,故c正确;
d.B与C形成的化合物为氧化钠、过氧化钠,过氧化钠中含有非极性键,故d正确;
e.H、Na位于周期表的s区,Cu处于周期表中ds区,故e错误.
故答案为:cd;
(2)B单质有两种同素异形体有氧气、臭氧,O2分子为非极性分子,而O3分子为极性分子,水分子是极性分子,相似相溶,故在水中溶解度较大的是O3,
故答案为:O3;O2分子为非极性分子,而O3分子为极性分子,水分子是极性分子,相似相溶;
(3)CaH2属于离子晶体,H2O属于分子晶体,熔点较高的是CaH2,
故答案为:CaH2;CaH2属于离子晶体,H2O属于分子晶体;
(4)SO2分子中S原子孤电子对数=$\frac{6-2×2}{2}$=1,价层电子对数=2+1=3,故S原子的杂化类型是 sp2,
SO3中S原子孤电子对数=$\frac{6-2×3}{2}$=0,价层电子对数为3+3=3,为平面三角形结构,NH3为三角锥形结构,SO32-中S原子孤电子对数=$\frac{6+2-2×3}{2}$=1,价层电子对数=3+1=4,为三角锥形结构,NO3- 中N原子孤电子对数=$\frac{5+1-2×3}{2}$=0,价层电子对数=3+0=3,为平面三角形结构,PCl3为三角锥形结构,
故答案为:sp2;c;
(5)甲中Cu原子数目为4,氧原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,化学式为CuO,乙中Cu原子数目为4,氧原子数目为1+8×$\frac{1}{8}$=2,化学式为Cu2O,Cu2+外围电子排布为3d9,而Cu+外围电子排布为3d10,属于稳定结构,故高温下CuO可以转化为Cu2O,
乙晶体密度为pg/cm3,乙晶胞质量为2×$\frac{144}{{N}_{A}}$g,则晶胞参数=$\root{3}{\frac{2×\frac{144}{{N}_{A}}g}{pg/c{m}^{3}}}$=$\root{3}{\frac{288}{p{N}_{A}}}$cm=$\root{3}{\frac{288}{p{N}_{A}}}$×107 nm,
故答案为:CuO中Cu2+外围电子排布为3d9,而Cu2O中Cu+外围电子排布为3d10,属于稳定结构;$\root{3}{\frac{288}{p{N}_{A}}}$×107 .
点评 本题是对物质结构与性质的考查,推断元素是解题关键,涉及核外电子排布、元素周期律、电离能、电负性、杂化方式与空间构型判断、分子结构与性质、晶胞计算等,元素推断难度较大,较好地考查学生分析推理能力,难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol 氢氧根和1 mol 羟基中含有的质子数均为 9 NA | |
| B. | 1mol Cl2参加反应,转移电子数一定为2NA | |
| C. | 标准状况下,2.24 L氯仿(CHCl3)中含有C-Cl数目为0.3NA | |
| D. | 0.5 mol O3与11.2 LO2所含的分子数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;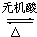 CH3COOH+(CH3)2CHOH.
CH3COOH+(CH3)2CHOH.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Cu片作阳极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+H2↑+2OH- | |
| B. | 用两个铜片作电极电解AgNO3溶液:4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$Ag+O2+4H+ | |
| C. | 用石墨作电极电解AlCl3溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 用石墨作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.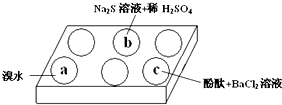
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题



| A. | ①②③④⑤ | B. | ②④⑥ | C. | ③⑤⑥ | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com