
分析 除去氯化钾固体中混有的氯化铜(不引进其他杂质),要求所加入的溶液即沉淀铜离子又能生成氯化钾,根据复分解反应的规律,应选择氢氧化钾溶液;
反应溶液为氯化钾溶液,其中氯化钾一部分为原固体中氯化钾,一部分为为反应生成氯化钾.
解答 解:(1)氢氧化钠与氯化铜生成氯化钠,不符合题意;硫酸钠与氯化铜不形成沉淀、气体、水,不能发生反应;氢氧化钾与氯化铜生成氯化钾和氢氧化铜沉淀;
故答:氢氧化钾;
(2)设混合物中氯化铜的质量为x,生成氯化钾的质量为y.
CuCl2+2KOH═Cu(OH)2↓+2KCl
135 98 149
x 9.8g y
$\frac{135}{x}=\frac{98}{9.8g}$解之得x=13.5g
$\frac{98}{9.8g}=\frac{149}{y}$解之得y=14.9g
反应后所得溶液中溶质的质量分数为:$\frac{59.8g-13.5g+14.9g}{59.8g+200g+60g-9.8g}$×100%=19.7%,
答:混合物中氯化铜的质量为13.5g,反应后所得溶液中溶质的质量分数为19.7%.
点评 本题考查化学方程式的计算,学生抓住反应后所得溶液的质量根据质量守恒,溶液质量=混合固体物质质量+水的质量+所加溶液质量-生成沉淀质量.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 反应①为取代反应,有机产物与水混合浮在上层 | |
| B. | 反应③为取代反应,有机产物是一种烃 | |
| C. | 反应②为氧化反应,反应现象是火焰明亮并带有浓烟 | |
| D. | 反应④中1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
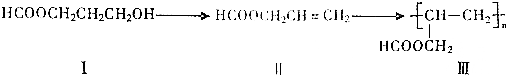
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸试剂可以做干燥剂,干燥任何气体 | |
| B. | 稀释该硫酸时,应将蒸馏水沿玻璃棒缓慢注入其中 | |
| C. | 常温下,2.7g Al与足量的稀硫酸反应得到H23.36L | |
| D. | 配制200mL 4.6mol•L-1的稀硫酸需取该硫酸50.0mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| B. | 2HCO3-+2AlO2-+H2O=2CO2↑+2Al(OH)3↓ | |
| C. | NH4++AlO2-+2H2O=NH3•H2O+Al(OH)3↓ | |
| D. | 3H++Al(OH)3=Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | W | R | X | Y | Z | Q |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2、+4 | -3、+5 |
 ;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键.1mol丙气体可与2mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式O=C=C=C=O.
;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键.1mol丙气体可与2mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式O=C=C=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发时,只要蒸发皿中出现固体,立即停止加热 | |
| B. | 蒸馏时,温度计水银球应插入液体中,但不能碰到烧瓶内壁 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com