
【题目】2011年为国际化学年,主题为“化学—我们的生活,我们的未来”下列说法正确的是
A. 制作航天服的聚酯纤维和用于光缆通信的晶体硅都是新型无机非金属材料
B. 金刚砂的成分是Al2O3,可用作砂纸、砂轮的磨料
C. 石油化工生产广泛使用过渡元素做催化剂并加入少量稀土元素改善催化剂的性能
D. 福尔马林(甲醛溶液)可用于浸泡生肉及海产品以防腐保鲜
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】人体内有20多种微量元素,它们的质量总和不到体重的千万分之一,但是对人的健康却起着重要的作用,下列各组元素全部是微量元素的是( )
A. Na K Cl S O B. B Mn Fe Zn Cu
C. N H O P C D. Ge Ca Cu Mg C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:
2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) △H<0
①该反应中,反应物总能量_____(填“>”、“<”或“=”)生成物总能量。
②当该反应有2mol N2(g)生成时,转移电子的物质的量为__mol。
③该反应中,还原剂为______(填化学式),氧化产物与还原产物的质量比为______________。
(2)也可以利用甲烷催化还原氮氧化物.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是_________________。
(3)还可利用ClO2消除氮氧化物的污染,反应过程如下(部分反应物或生成物略去):![]()
反应I的产物中还有两种强酸生成,且其中一种强酸为硝酸,且硝酸与NO3物质的量相等,则化学反应方程式为______,反应中若生成22.4L N2(标准状况),则消耗ClO2______g。
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。

①氢氧燃料电池的能量转化主要形式是________,工作时电流方向为________(用a、b和箭头表示)。
②负极的电极反应式为__________________。
③电极表面镀铂粉的原因为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D四种元素,原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出D元素价电子的电子排布式:______________。
(2)D可形成化合物[D(H2O)6](NO3)3 。
①[D(H2O)6](NO3)3中阴离子的立体构型是_____________。NO3-中心原子的轨道杂化类型为__________。
②在[D(H2O)6] 3+中D3+与H2O之间形成的化学键称为______,1 mol [D(H2O)6] 3+ 中含有的σ键有________mol。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中________(填化学式)为非极性分子。另一种物质的电子式为_____________。
(4)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图以及晶胞的剖面图:
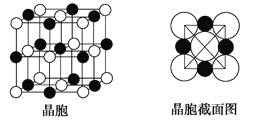
晶胞中距离一个A+最近的C-有________个,这些C-围成的图形是______________,若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则A+的离子半径为________cm(用含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将蔗糖用少量水湿润,然后在不断搅拌下加入浓硫酸,可看到蔗糖颜色变黑,体积逐渐膨胀,最后变成多孔的疏松固体,且产生刺激性气味的气体,上述过程中( )
A. 体现浓硫酸的吸水性 B. 体现了浓硫酸的脱水性
C. 体现了浓硫酸的吸水性和脱水性 D. 体现了浓硫酸的吸水性、脱水性和强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酰氯(COC12),俗称光气,常温下为气体,化学性质不稳定,遇水迅速水解得到强酸,工业用途广泛,是化工制品的重要中间体。
(1)实验室可利用氧气与氯仿(CHCl3)反应得到光气和一种氢化物,写出氧气与氯仿(CHC13)反应的化学反应方程式:_____________________________。
(2)工业上,常用CO与氯气反应得到光气,其热化学方程式为:CO(g)+Cl2(g)![]() COCl2(g) △H=-108 kJ/mol,已知:1 molCl2(g)、1molCO(g)化学键断裂分别需要吸收能量243kJ、1072kJ,则1molCOCl2(g)中化学键断裂需要吸收能量________kJ。
COCl2(g) △H=-108 kJ/mol,已知:1 molCl2(g)、1molCO(g)化学键断裂分别需要吸收能量243kJ、1072kJ,则1molCOCl2(g)中化学键断裂需要吸收能量________kJ。
(3)光气的分解反应为 COCl2(g)![]() CO(g)+Cl2(g) △H=+l08kJ/mol。温度为T1时,该可逆反应在恒容密闭体系中,各物质的浓度与时间关系如下表所示:
CO(g)+Cl2(g) △H=+l08kJ/mol。温度为T1时,该可逆反应在恒容密闭体系中,各物质的浓度与时间关系如下表所示:
浓度/mol L-1 时间/min | COCl2(g) | CO(g) | Cl2(g) |
0 | 0.1300 | 0.0050 | 0.0050 |
5 | 0.0400 |
①在5 min 时恰好达到平衡状态,该反应在此温度下的平衡常数K=________(精确到小数点后两位)。
②0~5min 内,v(COCl2)=_________。
③若保持温度不变,再向容器中充入一定量COCl2 (g),重新达到平衡,此时COCl2 (g)的转化率a(COCl2)_________(填“增大”“减小”或“不变”),试用平衡常数解释原因______________________。
④保持其他条件不变,改变反应温度至T2,反应重新达到平衡,此时测得c(CO)=0.0850 mol/L,则T1________T2(填“>”、“<”、“=”),理由是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由锌、铁、铝、镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有的金属是( )
A. 锌 B. 铁 C. 铝 D. 镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量转换的认识中不正确的是
A. 白炽灯工作时,电能全部转化为光能
B. 普通干电池工作时将化学能转变为电能
C. 化学反应中的能量变化,通常主要表现为热量的变化
D. 火力发电是通过化石燃料燃烧,使化学能经过一系列能量转化最终转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种元素中,其非金属性最强的是( )
A. 原子最外层电子排布为2s22p6的元素
B. 原子最外层电子排布为3s23p5的元素
C. 原子含有未成对电子最多的第二周期元素
D. 位于周期表中第三周期ⅢA族的元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com