
،¾جâؤ؟،؟شعبف»خھ2 Lµؤأـ±صبفئ÷ضذ£¬سذ·´س¦mA(g)£«nB(g)![]() pC(g)£«qD(g)£¬¾¹5 min´ïµ½ئ½؛⣬´ثت±¸÷خïضتµؤ±ن»¯خھAخïضتµؤء؟إ¨¶ب¼ُةظamol،¤L£1£¬Bµؤئ½¾ù·´س¦ثظآتv(B)£½a/15 mol،¤L£1،¤min£1£¬Cخïضتµؤء؟إ¨¶بشِ¼س2a/3 mol،¤L£1£¬صâت±بôشِ´َدµح³ر¹ا؟£¬·¢دضAسëCµؤ°ظ·ض؛¬ء؟²»±ن£¬شٍm،أn،أp،أqخھ(،،،،)
pC(g)£«qD(g)£¬¾¹5 min´ïµ½ئ½؛⣬´ثت±¸÷خïضتµؤ±ن»¯خھAخïضتµؤء؟إ¨¶ب¼ُةظamol،¤L£1£¬Bµؤئ½¾ù·´س¦ثظآتv(B)£½a/15 mol،¤L£1،¤min£1£¬Cخïضتµؤء؟إ¨¶بشِ¼س2a/3 mol،¤L£1£¬صâت±بôشِ´َدµح³ر¹ا؟£¬·¢دضAسëCµؤ°ظ·ض؛¬ء؟²»±ن£¬شٍm،أn،أp،أqخھ(،،،،)
A.3،أ1،أ2،أ2B.1،أ3،أ2،أ2C.3،أ1،أ2،أ1D.1،أ1،أ1،أ1
،¾´ً°¸،؟A
،¾½âخِ،؟
¸ù¾فجâضذ·´س¦mA(g)£«nB(g)![]() pC(g)£«qD(g)؟ةضھ£¬±¾جâ؟¼²é»¯ر§·´س¦ثظآت£¬شثسأ»¯؛د·´س¦ثظآتض®±بµبسع»¯ر§¼ئء؟تض®±ب·ضخِ،£
pC(g)£«qD(g)؟ةضھ£¬±¾جâ؟¼²é»¯ر§·´س¦ثظآت£¬شثسأ»¯؛د·´س¦ثظآتض®±بµبسع»¯ر§¼ئء؟تض®±ب·ضخِ،£
Bµؤئ½¾ù·´س¦ثظآتv(B)£½![]() mol،¤L£1،¤min£1£¬شٍBµؤإ¨¶ب¼ُةظ
mol،¤L£1،¤min£1£¬شٍBµؤإ¨¶ب¼ُةظ![]() mol،¤L£1،¤min£1،ء5min£½
mol،¤L£1،¤min£1،ء5min£½![]() mol،¤L£1،£سضزٍخھإ¨¶بµؤ±ن»¯ء؟ض®±بتادàس¦µؤ»¯ر§¼ئء؟تض®±ب£¬ثùزشm،أn،أp£½a،أ
mol،¤L£1،£سضزٍخھإ¨¶بµؤ±ن»¯ء؟ض®±بتادàس¦µؤ»¯ر§¼ئء؟تض®±ب£¬ثùزشm،أn،أp£½a،أ![]() ،أ
،أ![]() a£½3£؛1£؛2£¬سةسعشِ¼سدµح³ر¹ا؟£¬A،¢Cµؤ°ظ·ض؛¬ء؟²»±ن£¬ثùزش¸أ·´س¦خھµبجه»·´س¦£¬¼´3£«1£½2£«q£¬¼´q£½2£¬
a£½3£؛1£؛2£¬سةسعشِ¼سدµح³ر¹ا؟£¬A،¢Cµؤ°ظ·ض؛¬ء؟²»±ن£¬ثùزش¸أ·´س¦خھµبجه»·´س¦£¬¼´3£«1£½2£«q£¬¼´q£½2£¬
¹ت´ً°¸ر،£؛A،£



| ؤ꼶 | ¸كضذ؟خ³ج | ؤ꼶 | ³ُضذ؟خ³ج |
| ¸كز» | ¸كز»أâ·ر؟خ³جحئ¼ِ£، | ³ُز» | ³ُز»أâ·ر؟خ³جحئ¼ِ£، |
| ¸ك¶ | ¸ك¶أâ·ر؟خ³جحئ¼ِ£، | ³ُ¶ | ³ُ¶أâ·ر؟خ³جحئ¼ِ£، |
| ¸كب | ¸كبأâ·ر؟خ³جحئ¼ِ£، | ³ُب | ³ُبأâ·ر؟خ³جحئ¼ِ£، |
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟°¢ث¾ئ¥ءض(»¯ر§أû³ئخھززُ£ث®رîثل)تا¾كسذ½â¶¾،¢صٍح´µب¹¦ذ§µؤ¼زح¥³£±¸ز©£¬؟ئر§¼زسأثüء¬½سشع¸ك·ض×سشطجهةدضئ³ة»؛تح³¤ذ§°¢ث¾ئ¥ءض£¬ئن²؟·ض؛د³ة¹³جبçدآ£؛
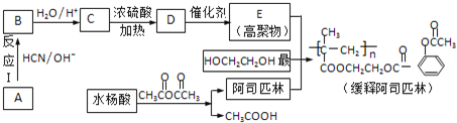
زرضھ£؛ب©»ٍحھ¾ù؟ة·¢ةْدآءذ·´س¦£؛CH3CHO ![]()
(1)ث®رîثلµؤ»¯ر§أû³ئخھءعôا»ù±½¼×ثل£¬شٍث®رîثلµؤ½ل¹¹¼ٍت½خھ__£»
(2)·´س¦¢ٌµؤ·´س¦ہàذحتا__·´س¦£®HOCH2CH2OH؟ةسة1£¬2©پ¶نهززحéضئ±¸£¬تµدض¸أضئ±¸ثùذèµؤ·´س¦تش¼ءتا__£»
(3)ذ´³ِC،ْDµؤ·´س¦·½³جت½______£»
(4)C؟ة·¢ةْثُ¾غ·´س¦ةْ³ة¸ك¾غخ¸أ¸ك¾غخïµؤ½ل¹¹¼ٍت½خھ____£»
(5)°¢ث¾ئ¥ءضسë¼×´¼ُ¥»¯µؤ²ْخïشعاâرُ»¯ؤئبـز؛ضذ³ن·ض·´س¦µؤ»¯ر§·½³جت½خھ______£»
(6)دآءذثµ·¨صب·µؤتا__£»
a£®·سأ°¢ث¾ئ¥ءض³ِدضث®رîثلضذ¶¾£¬س¦ء¢¼´ح£ز©£¬²¢¾²آِ×¢ةنNaHCO3بـز؛
b£®1mol HOCH2CH2OHµؤ´ك»¯رُ»¯²ْخïسëزّ°±بـز؛·´س¦£¬ہيآغةد×î¶àةْ³ة2molزّ
c£®Aµؤ؛ث´إ¹²صٌاâئ×ض»سذز»×é·ه
d£®ء½·ض×سC·¢ةُْ¥»¯·´س¦؟ةةْ³ة8شھ»·×´ُ¥
(7)ذ´³ِ»؛تح°¢ث¾ئ¥ءضشعجهؤعث®½âةْ³ة°¢ث¾ئ¥ءض،¢¸ك¾غخïEµبخïضتµؤ·´س¦·½³جت½__£»
(8)ث®رîثلسذ¶àضضح¬·ضزى¹¹جه£¬ئنضذتôسع·سہàازؤـ·¢ةْزّ¾µ·´س¦µؤح¬·ضزى¹¹جهسذ__ضض،£
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟³£خآدآ£¬دآءذسذ¹طبـز؛µؤثµ·¨صب·µؤتا£¨ £©
A. pHدàµبµؤ¢ظNH4Cl،¢¢عNH4Al(SO4)2،¢¢غNH4HSO4بـز؛£؛إ¨¶بµؤ´َذ،ث³ذٍخھ¢ظ>¢ع>¢غ
B. HAµؤµçہë³£تKa =4.93،ء1010£¬شٍµبإ¨¶بµؤNaA،¢HA»ى؛دبـز؛ضذ£؛c(Na+) >c(HA) >c(A)
C. NaHCO3بـز؛¼سث®د،تح£¬c(Na+)سëc(HCO3)µؤ±بضµ½«¼ُذ،
D. زرضھشعدàح¬جُ¼دآثلذشHF >CH3COOH£¬شٍخïضتµؤء؟إ¨¶بدàµبµؤNaFسëCH3COOKبـز؛ضذ£؛c(Na+) ¨C c(F) >c(K+ ) c(CH3COO)
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟¹ْ¼ت°آخ¯»ل¹«²¼µؤخ¥½ûز©خïسذ138ضض£¬ئنضذؤ³ضضذث·ـ¼ء·ض×س½ل¹¹بçح¼£¬¹طسعثüµؤثµ·¨صب·µؤتا£¨،،،،£©

A. ¸أخïضتتôسع·¼دمج
B. ¸أ·ض×سضذثùسذج¼ش×س¹²أو
C. 1mol¸أخïضتسëاâرُ»¯ؤئبـز؛حêب«·´س¦£¬×î¶àدû؛ؤ2molNaOH
D. ¸أخïضتµؤ»¯ر§ت½خھC15H24ClNO2
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟![]() تاز»ضضضطزھµؤ»¯¹¤شءد£¬؟ةسأسع؛د³ة؟ة½µ½âµؤ¸ك¾غخïPESت÷ض¬زش¼°¾كسذ؟¹ض×ءِ»îذشµؤ»¯؛دخïK،£
تاز»ضضضطزھµؤ»¯¹¤شءد£¬؟ةسأسع؛د³ة؟ة½µ½âµؤ¸ك¾غخïPESت÷ض¬زش¼°¾كسذ؟¹ض×ءِ»îذشµؤ»¯؛دخïK،£

زرضھ:i.R1CO18OR2+R3OH![]() R1COOR3+R218OH
R1COOR3+R218OH
ii. 
¢£.  (R1،¢R2،¢R3´ْ±يج»ù)
(R1،¢R2،¢R3´ْ±يج»ù)
£¨1£©Aµؤأû³ئتا_________£»Cµؤ¹ظؤـحإµؤأû³ئتا_________،£
£¨2£©B·ض×سخھ»·×´½ل¹¹£¬؛ث´إ¹²صٌاâئ×ض»سذز»×é·ه£¬Bµؤ½ل¹¹¼ٍت½خھ_________ .
£¨3£©E·ض×سضذ؛¬سذء½¸ُِ¥»ù£¬ازخھث³ت½½ل¹¹£¬Eµؤ½ل¹¹¼ٍت½خھ_________ .
£¨4£©·´س¦¢ظµؤ»¯ر§·½³جت½خھ_________ ،£
£¨5£©تش¼ءaµؤ½ل¹¹¼ٍت½خھ_________£»·´س¦¢عثùتôµؤ·´س¦ہàذحخھ________·´س¦،£
£¨6£©زرضھ:  ،£زش1£¬3-¶،¶د©خھئًت¼شءد£¬½ل؛دزرضھذإد¢ر،سأ±طزھµؤخق»ْتش¼ء؛د³ة
،£زش1£¬3-¶،¶د©خھئًت¼شءد£¬½ل؛دزرضھذإد¢ر،سأ±طزھµؤخق»ْتش¼ء؛د³ة![]() ،£½«زشدآ؛د³ةآ·دك²¹³نحêصû:_________________
،£½«زشدآ؛د³ةآ·دك²¹³نحêصû:_________________

£¨7£©زرضھ°±»ù(-NH2)سëôا»ùہàثئ£¬ز²ؤـ·¢ةْ·´س¦i،£شعسةJضئ±¸Kµؤ¹³جضذ£¬³£»ل²ْةْ¸±²ْخïL،£L·ض×ست½خھC16H13NO3£¬؛¬ب¸ِءùشھ»·£¬شٍLµؤ½ل¹¹¼ٍت½خھ________،£
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟خآ¶بخھTت±£¬دٍ2Lµؤأـ±صبفئ÷ضذ³نبëز»¶¨ء؟µؤA؛حB£¬·¢ةْ·´س¦£؛A(g)+B(g)![]() C(g)+xD(g)،،¦¤H£¾0£¬بفئ÷ضذA،¢B،¢Dµؤخïضتµؤء؟ثوت±¼نµؤ±ن»¯بçح¼ثùت¾،£دآءذثµ·¨صب·µؤتا£¨ £©
C(g)+xD(g)،،¦¤H£¾0£¬بفئ÷ضذA،¢B،¢Dµؤخïضتµؤء؟ثوت±¼نµؤ±ن»¯بçح¼ثùت¾،£دآءذثµ·¨صب·µؤتا£¨ £©

A.·´س¦ا°10minؤع·´س¦µؤئ½¾ùثظآتخھv(D)=0.3mol،¤L-1،¤min-1
B.·´س¦ضء15minت±£¬ئنثûجُ¼²»±ن£¬¸ؤ±نµؤجُ¼؟ةؤـتاثُذ،بفئ÷جه»
C.بôئ½؛âت±±£³ضخآ¶ب²»±ن£¬ر¹ثُبفئ÷جه»£¬ئ½؛âؤودٍزئ¶¯£¬ئ½؛â³£تKضµ¼ُذ،
D.·´س¦ضء15minت±£¬ئنثûجُ¼²»±ن£¬¸ؤ±نµؤجُ¼؟ةؤـتا½µµح·´س¦جهدµخآ¶ب
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟شع20 Lµؤأـ±صبفئ÷ضذ°´خïضتµؤء؟ض®±ب1،أ2³نبëCO؛حH2,·¢ةْ:CO(g)+2H2(g) ![]() CH3OH(g)،،¦¤H،£²âµأCOµؤ×ھ»¯آتثوخآ¶بµؤ±ن»¯¼°²»ح¬ر¹ا؟دآCO×ھ»¯آتµؤ±ن»¯،¢p2؛ح195 ،وت±n(H2)ثوت±¼نµؤ±ن»¯½ل¹ûبçح¼±يثùت¾،£دآءذثµ·¨صب·µؤتا(،،،،)
CH3OH(g)،،¦¤H،£²âµأCOµؤ×ھ»¯آتثوخآ¶بµؤ±ن»¯¼°²»ح¬ر¹ا؟دآCO×ھ»¯آتµؤ±ن»¯،¢p2؛ح195 ،وت±n(H2)ثوت±¼نµؤ±ن»¯½ل¹ûبçح¼±يثùت¾،£دآءذثµ·¨صب·µؤتا(،،،،)

A.0،«3 min,ئ½¾ùثظآتv(CH3OH)=0.8 mol،¤L-1،¤min-1
B.p1<p2,¦¤H>0
C.شعp2؛ح195 ،وت±,¸أ·´س¦µؤئ½؛â³£تخھ25£¨ mol،¤L-1£©-2
D.شعBµمت±,vص>vؤو
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟½«جْ·غ؛ح»îذشج؟µؤ»ى؛دخïسأNaClبـز؛تھبَ؛َ£¬ضأسعبçح¼ثùت¾×°ضأضذ£¬½ّذذجْµؤµç»¯ر§¸¯ت´تµرé،£دآءذسذ¹ط¸أتµرéµؤثµ·¨صب·µؤتا
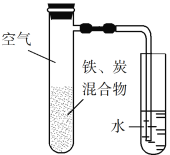
A. جْ±»رُ»¯µؤµç¼«·´س¦ت½خھFe3e![]() Fe3+
Fe3+
B. جْ¸¯ت´¹³جضذ»¯ر§ؤـب«²؟×ھ»¯خھµçؤـ
C. »îذشج؟µؤ´وشع»ل¼سثظجْµؤ¸¯ت´
D. زشث®´ْجوNaClبـز؛£¬جْ²»ؤـ·¢ةْخüرُ¸¯ت´
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟سذز»ضض»¯؛دخïتا؛ـ¶à±يأوح؟²مµؤضطزھ³ة·ض£¬ئن½ل¹¹بçح¼ثùت¾£¬ئنضذW،¢X،¢Y،¢Zخھش×سذٍتزہ´خشِ´َµؤ¶جضـئعض÷×هشھثط£¬ض»سذX،¢Yشعح¬ز»ضـئع£¬Yخق×î¸كص¼غ£¬Zµؤ؛¬رُثل¾ù¾كسذرُ»¯ذش£¬دآءذسذ¹طثµ·¨صب·µؤتا£¨ £©

A.WZ·ذµم¸كسعW2Yµؤ·ذµم
B.؛¬Zµؤء½ضضثل·´س¦؟ةضئµأZµؤµ¥ضت
C.W2Y2ضذ¼ب؛¬ہë×س¼üسض؛¬¹²¼غ¼ü¼ü
D.Xµؤ؛¬رُثلز»¶¨خھ¶شھبُثل
²é؟´´ً°¸؛ح½âخِ>>
¹ْ¼تر§ذ£سإر، - ء·د°²لءذ±ي - تشجâءذ±ي
؛±±ت،»¥ءھحّخ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨ئ½ج¨ | حّةدسذ؛¦ذإد¢¾ظ±¨×¨اّ | µçذإص©ئ¾ظ±¨×¨اّ | ةوہْت·ذéخقض÷زهسذ؛¦ذإد¢¾ظ±¨×¨اّ | ةوئَاضب¨¾ظ±¨×¨اّ
خ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨µç»°£؛027-86699610 ¾ظ±¨ستدن£؛58377363@163.com