
【题目】X元素最高价氧化物对应水化物的化学式为H2XO4,该元素的气态氢化物的化学式是( )
A.HXB.H2XC.XH3D.XH4
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】下列关于1.5mol氢气的叙述错误的是( )
A.体积是33.6LB.质量是3g
C.所含电子的物质的量是3molD.氢原子数目约为3×6.02×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知饱和氯化铵溶液与亚硝酸钠晶体混合加热可制备氮气。利用如下装置制取氮气,并用氮气制备Ca3N2,Ca3N2遇水发生水解反应。下列说法错误的是
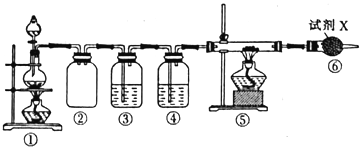
A. ①中发生的化学反应为NaNO2+NH4Cl![]() NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
B. ④、⑥中依次盛装的试剂可以是浓H2SO4、碱石灰
C. ③中盛放的试剂是NaOH 溶液
D. 实验结束,取⑤中的少量产物于试管中,加适量蒸馏水,可以使试管口湿润的红色石蕊试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火力发电厂释放出大量氮的氧化物(NOx)、二氧化硫等气体会造成环境污染,对燃煤废气进行脱除处理。可实现绿色环保、低碳减排、废物利用等目的。
(1)己知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g)=CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g)△H=-221 kJ·mol-1
若某反应的平衡常数表达式为: 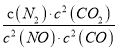 ,请写出此反应的热化学方程式_________。
,请写出此反应的热化学方程式_________。
(2)脱硝
利用甲烷与NO2反应,生成无污染的物质,则该反应的化学方程式为:___________。
(3)脱碳
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线(见如图1),则上述CO2转化为甲醇反应的△H3_____0(填“>”、“<”或“=”)。
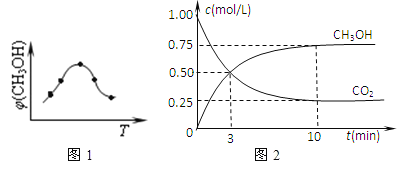
②在一恒温恒容密闭容器中充入0.5molCO2和1.5molH2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如上图2所示.请回答:第10min后,若升温,该反应的平衡常数将_____(填“变大”、“变小”、“不变”);若向该容器中再充入1molCO2和3molH2再次达到平衡时,则CH3OH(g)的体积分数将___(“变大”、“变小”、“不变”)。
(4)脱硫
某种脱硫工艺中将废气经处理后,与一定量的氨气、潮湿的空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为__________。若在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,配制了pH=8.2的溶液,则该溶液中微粒浓度由大到小的顺序为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两根金属棒插入Z溶液中构成如图所示的装置,实验中电流计指针发生偏转,同时X棒变粗,Y棒变细,则X、Y和Z溶液可能是下列中的( )
编号 | X | Y | Z溶液 |
|
A | Zn | Cu | 稀硫酸 | |
B | Cu | Zn | 稀硫酸 | |
C | Cu | Ag | 硫酸铜溶液 | |
D | Ag | Zn | 硝酸银溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,充入一定量的反应物A,反应![]() 达平衡后,保持温度不变,将容器体积缩到一半,当达到新的平衡时,B的浓度是原来的1.6倍,则
达平衡后,保持温度不变,将容器体积缩到一半,当达到新的平衡时,B的浓度是原来的1.6倍,则
A. 平衡向正反应方向移动了 B. 物质A的转化率降低
C. 物质B的质量增加 D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 实验室常用排饱和食盐水的方法收集氯气
B. 在硫酸亚铁溶液中,加入铁粉以防止氧化
C. 酯在碱性条件下水解的程度较为完全
D. 氨水应密闭保存,放置低温处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给你提供纯锌片、纯铜片和100 mL 0.5 mol/L的H2SO4溶液、导线、1 000 mL量筒。试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。
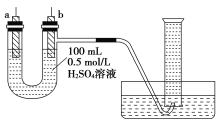
(1)如图所示,装置气密性良好,且1 000 mL量筒中已充满了水,则开始实验时,首先要____________________________。
(2)a电极材料为________,电极反应式为____________________________;b电极材料为________,电极反应式为________________________。
(3)当量筒中收集672 mL气体时(已折算到标准状况下),通过导线的电子的物质的量为________,________(填“a”或“b”)极质量减少________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com