
关于下列各实验装置的叙述中,不正确的是( )

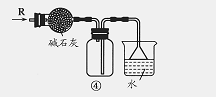
A.装置①可用于分离C2H5OH和H2O的混合物
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
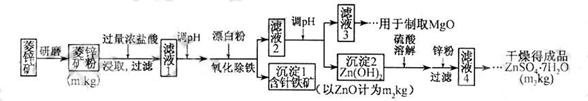
(1) 将菱锌矿研磨成粉的目的是_____。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Go ethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
ethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液 2”的pH时,理论上可选用的最大区间为______。
2”的pH时,理论上可选用的最大区间为______。
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6× | — | 6.8× | 2.8× |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。K^S*5U.C#O%
a.大理石粉  b.石灰乳 c.纯碱溶液 d.烧碱溶液
b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甘蔗渣可综合利用,回答下列问题。
Ⅰ. 甘蔗渣可生成一种常见单糖A,A在乳酸菌的作用下生成有机物B,B经过缩聚反应生成可降解塑料,其结构简式为: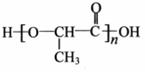
(1)A的分子式是____________;
(2)下列有关B的叙述正确的是____________(填序号);
A. B的分子式为C3H6O3 B. 1 mol B可与2 mol NaOH反应
C. 1 molB与足量的Na反应可生成1 molH2
(3)B在一定条件下可生成C,C能使溴的四氯化碳溶液褪色。B生成C的化学方程式是____________;
Ⅱ. 甘蔗渣还可生产一种重要的化工原料D,D的相对分子质量为90,1 mol D与足量NaHCO3反应放出标准状况下44.8 L CO2。
(4)D的官能团名称是____________;
(5)等物质的量的D与乙二醇在催化剂作用下可生成链状高分子化合物,其化学方程式是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
我国缺碘病区甚广,防治缺碘病的主要措施是食盐中加碘。1996年我国政府以国家标准的方式规定食盐的碘添加剂是KIO3。
(1)可用盐酸酸化的KI和淀粉的混合物检验食盐是否为加碘盐,反应的化学方程式为__________________________________
(2)可用电化学方法制备KIO3。原理是:以石墨为阳极,不锈钢为阴极,以KI溶液(加入少量K2Cr2O7)为电解质溶液,在一定电流强度和温度下进行电解,其电解总反应方程式为KI+3H2O KIO3+3H2↑。试写出两极反应式:阳极_____________;阴极_____________。
KIO3+3H2↑。试写出两极反应式:阳极_____________;阴极_____________。
(3)如果在容积为10 L的离子交换膜电解槽中,1 min时阴极可产生11.2 L(标准状况)Cl2,这时溶液的pH是(设体积维持不变)_____________。
(4)Cl2常用于自来水的消毒杀菌,现有一种新型消毒剂ClO2,若它们在杀菌过程中的还原产物均为Cl-,消毒等量的自来水,所需Cl2和ClO2的物质的量之比为_____________。
方法指引:在正确书写电解反应方程式的基础上,关键把握电解过程中的等量关系,然后进行综合处理,便可解决。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.石油分馏、煤的气化、海水制食盐、蛋白质变性等过程都包含化学变化
B. 酸性氧化物一定不能和酸反应
C. 稀豆浆、硅酸、氯化铁溶液均为胶体
D.爆鸣气、铝热剂、玻璃、花生油、聚乙烯均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式__________________________________________________
 (2)下列三种情况下,离子方程式与(1)相同的是________(填序号).
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO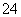 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
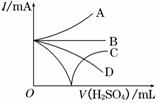
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用右图中的曲线表示是________(填序号).
(4)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.则反应的离子方程式是 _________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或结论正确的是( )
A.配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,不漏水
B.实验室里需要480 mL 2.0 mol·L-1的氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、洗涤、定容、摇匀的步骤进行操作
C.25℃时,用惰性电极电解某浓度的NaOH溶液,一小段时间后,NaOH溶液的浓度可能增大,也可能不变
D.实验室配制500 mL 0.2 mol/L的硫酸亚铁溶液,其操作是:用天平称27.8 g绿矾,放入500 mL容量瓶,加水溶解、稀释、定容、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电子排布中,原子处于激发状态的是
A.1s22s2 B.1s22s22p5 C.1s22s22p63s23p63d34s2 D.1s22s12p3
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.【查阅资料】
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀盐酸。
Ⅱ.【制备产品】
实验装置如图所示(省略夹持装置):
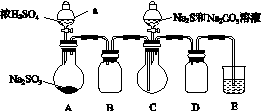
实验步骤:
(1)检查装置气密性,如图示加入试剂。
仪器a的名称是________;E中的试剂是________(选填下列字母编号)。
A.稀H2SO4
B.NaOH溶液
C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3的混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中的混合物,滤液经________(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.【探究与反思】
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________________________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是______________________________________________________________________________。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过________方法提纯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com