
| 1 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑨ | ⑩ | ||
| 4 | ② | ④ |
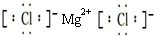 ;①和⑦两元素形成四核化合物过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在共价键,其电子式为
;①和⑦两元素形成四核化合物过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在共价键,其电子式为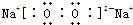 ;过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:
;过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为: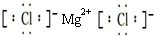 ;
;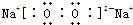 ;2Na2O2+2CO2=2Na2CO3+O2.
;2Na2O2+2CO2=2Na2CO3+O2.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
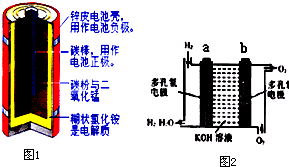
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | D | E | F | G |
| 所有原子中半径最小 | 基态原子核外只有三个能级,且各能级电子数相等 | 由D形成的两种单质,其中之一是地球生物的“保护伞” | 短周期中第一电离能量小 | 单质为淡黄色晶体,不溶于水,微溶于酒精 | 最外层只有一个电子,次外层填满电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试剂 | 离子反应方程式 | |
| ①NaHCO3溶液(Na2CO3) | ||
| ②Fe2O3溶液(Al2O3) | ||
| ③Fe粉(Al粉) | ||
| ④FeCl3溶液(FeCl2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入的NaOH 不够 |
| B、加入的CuSO4 不够 |
| C、未用水浴加热 |
| D、加入的乙醛太少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | W |
| A、原子半径由小到大的顺序为:Y<X<W<Z |
B、X元素最高价氧化物分子的比例模型为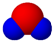 |
| C、Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性 |
| D、W的单质在地壳含量丰富,是国家经济发展的重要基础原材料.2005年美国科学家发现了W的“超级原子”结构-W13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com