
【题目】(1)已知金刚石中C—C键能小于C60中C—C键能,有同学据此认为C60的熔点高于金刚石,认为此说法是否正确__(填“正确”或“不正确”),并闸述理由__。
(2)格式试剂RMgX(R表示烃基、X表示卤素)遇水剧烈反应,生成可燃性烃RH和__。
(3)64g自燃性气体SiH4在25℃、101Kpa下充分完全燃烧生成液态水和固态氧化物时放出akJ热量,写出该自燃性气体燃烧热的热化学方程式__。
【答案】不正确 C60是分子晶体,熔化时破坏的是分子间作用力,无需破坏攻共价键,而分子间作用力较弱,所需能量较低,金刚石是原子晶体,熔化时破坏共价键,C60故熔点低于金刚石 Mg(OH)X或[MgX2和Mg(OH)2] SiH4(g)+ 2O2(g) = SiO2(s) +2H2O(l) ΔH =![]() kJ·mol1
kJ·mol1
【解析】
⑴C60是分子晶体,金刚石是原子晶体。
⑵根据原子守恒和RMgX和水反应生成可燃性烃RH得另外产物。
⑶1mol SiH4燃烧放出![]() kJ热量。
kJ热量。
⑴虽然金刚石中C—C键能小于C60中C—C键能,C60是分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键,而分子间作用力较弱,所需能量较低,金刚石是原子晶体,熔化时破坏共价键,故C60熔点低于金刚石;故答案为:不正确;C60是分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键,而分子间作用力较弱,所需能量较低,金刚石是原子晶体,熔化时破坏共价键,故C60熔点低于金刚石。
⑵格式试剂RMgX(R表示烃基、X表示卤素)遇水剧烈反应,RMgX和水反应生成可燃性烃RH,根据原子守恒,则另外产物可能为Mg(OH)X或[MgX2和Mg(OH)2];故答案为:Mg(OH)X或[MgX2和Mg(OH)2]。
⑶64g自燃性气体SiH4即物质的量为2mol,在25℃、101Kpa下充分完全燃烧生成液态水和固态氧化物时放出akJ热量,则1mol SiH4燃烧放出![]() kJ热量,因此该自燃性气体燃烧热的热化学方程式SiH4(g)+ 2O2(g) = SiO2(s) +2H2O(l) ΔH =
kJ热量,因此该自燃性气体燃烧热的热化学方程式SiH4(g)+ 2O2(g) = SiO2(s) +2H2O(l) ΔH =![]() kJ·mol1;故答案为:SiH4(g)+ 2O2(g) = SiO2(s) +2H2O(l) ΔH =
kJ·mol1;故答案为:SiH4(g)+ 2O2(g) = SiO2(s) +2H2O(l) ΔH =![]() kJ·mol1。
kJ·mol1。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除大气中的NOx(主要是NO和NO2)是环境保护的重要课题。
(1)用Pl-g-C3N4光催化氧化法脱除NO的过程如图-1所示。在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应:O2+2H++2e-=H2O2,Pl端的反应:___。

(2)次氯酸盐脱除NO的主要过程如下:
①NO+HClO=NO2+HCl
②NO+NO2+H2O![]() 2HNO2
2HNO2
③HClO+HNO2=HNO3+HCl
下列分析正确的是___。
a.烟气中含有的少量O2能提高NO的脱除率
b.NO2单独存在时不能被脱除
c.脱除过程中,次氯酸盐溶液的pH下降
(3)NaClO溶液能有效脱除NO。25℃时,NO的脱除率随pH的变化如图-2所示;pH=4时,NO的脱除率随温度的变化如图-3所示。
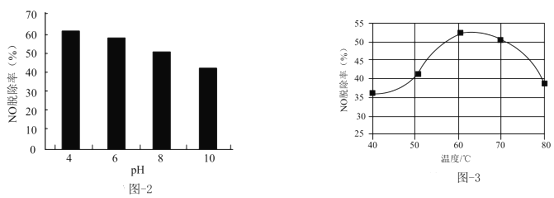
①25℃时,随着pH降低,NO的脱除率增大的原因:___。
②pH=4时,60~80℃NO的脱除率下降的原因:___。
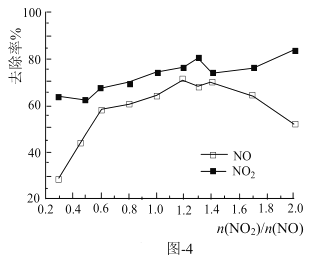
(4)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变![]() ,NOx的去除率如图-4所示。
,NOx的去除率如图-4所示。
已知:NO与Ca(OH)2不反应;
NOx的去除率=1-![]() ×100%
×100%
①![]() 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___。
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___。
②当![]() 大于1.4时,NO2去除率升高,但NO去除率却降价。其可能的原因是___。
大于1.4时,NO2去除率升高,但NO去除率却降价。其可能的原因是___。
③O3与NO反应的方程式为:NO+O3=NO2+O2,(该条件下不考虑O2与NO的反应)。保持NO的初始浓度不变,改变n(O3)/n(NO),将反应后的混合气体通入Ca(OH)2悬浊液中吸收。为节省O3的用量,又能保持NOx总去除效果好,则![]() 合适的值范围为___。(保留两位小数)
合适的值范围为___。(保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.等质量的甲烷和乙酸分别充分燃烧,消耗氧气的量相同
B.麦芽糖分子式为C12H22O11,能发生银镜反应
C.用新制氢氧化铜溶液可鉴别丙酸和丙醛两种无色液体
D.油脂的硬化反应属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14g乙烯和丙烯的混合物完全燃烧时,产生的CO2分子数目为0.5NA
B.1L0.1mol/L的CH3COONa溶液中含有的CH3COO-数目为0.1NA
C.15.6g由Na2S和Na2O2组成的混合物中,含有的阴离子数目为0.2NA
D.标准状况下,16gO2和O3混合物中含有的氧原子数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将两种硫酸盐按一定比例混合后共熔,可制得化合物M(化学式为xK2SO4·yCr2(SO4)3),若将2.83g化合物M中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr2O72-+3I2+7H2O,若向溶有2.83gM的溶液中,加入过量的BaCl2溶液,过滤洗涤干燥后可得到4.66g白色沉淀。
由此推断出化合物M中x:y为__。写出简要计算过程:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如下图所示: 下列有关说法正确的是

A.该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B.实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
C.沉淀乙一定有BaCO3,可能有BaSO4
D.一定没有Fe3+,但是无法确定是否含有I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,可由乙烷为原料制取,回答下列问题。
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
①C2H6(g)=C2H4(g)+H2(g) ΔH1=+136kJ·mol-1
②C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
已知反应相关的部分化学键键能数据如下:
化学键 | H-H(g) | H-O(g) | O=O |
键能(kJ·mol-1) | 436 | x | 496 |
由此计算x=___,通过比较ΔH1和ΔH2,说明和热裂解法相比,氧化裂解法的优点是___(任写一点)。
(2)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图甲为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是___,反应的最佳温度为___(填序号)。
A.700℃ B.750℃ C.850℃ D.900℃
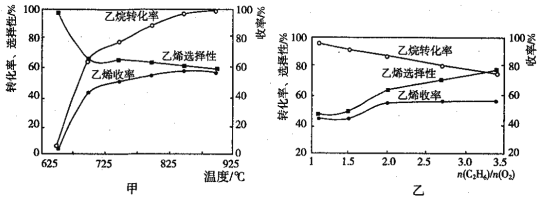
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
(3)烃类氧化反应中,氧气含量低会导致反应产生积炭堵塞反应管。图乙为![]() 的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中
的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中![]() 的最佳值是___,判断的理由是___。
的最佳值是___,判断的理由是___。
(4)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。反应达平衡时,各组分的体积分数如下表:
组分 | C2H6 | O2 | C2H4 | H2O | 其他物质 |
体积分数/% | 2.4 | 1.0 | 12 | 15 | 69.6 |
计算该温度下的平衡常数:Kp=___(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1.12LCl2溶于2L水,溶液中含氯粒子的数目等于0.1NA
B.含有C-Si键数目为2NA的SiC晶体中硅原子的物质的量为1mol
C.14.0gFe发生吸氧腐蚀最终生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
D.室温下,0.05mol/L的硝酸铵溶液中氮原子数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com