
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g),
2C1NO(g),
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g)K1
NaNO3(s)+ClNO(g)K1
②4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)K2
2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+C12(g)![]() 2C1NO(g)K3
2C1NO(g)K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):

则2NO(g)+C12(g)![]() 2C1NO(g)反应的△H和a的关系为△H=______________kJ/mol。
2C1NO(g)反应的△H和a的关系为△H=______________kJ/mol。
(3)300℃时.2NO(g)+C12(g)![]() 2ClNO(g)的正反应速率表达式为v正=k·cn(ClNO),
2ClNO(g)的正反应速率表达式为v正=k·cn(ClNO),
测得速率和浓度的关系如下表:

n=____________;k=____________(注明单位)。
(4)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:

①该反应的△H____________0(填“>”“<”或“=”)。
②反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min),
③T2时该反应的平衡常数K=____________
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是____________点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
【答案】
(1)K12/K2
(2)289-2a
(3)2;4.0×10-8L/(mo1·s)
(4)①<;②0.1;③2;
(5)A;D
【解析】
试题分析:(1)已知:①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g)
NaNO3(s)+ClNO(g)
②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)
将①×2-②可得:2NO(g)+Cl2(g)![]() 2ClNO(g),平衡常数K3=K12/K2,故答案为:K12/K2;
2ClNO(g),平衡常数K3=K12/K2,故答案为:K12/K2;
(2)2NO(g)+C12(g)![]() 2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和=(2×630+243)-(2a+2×607)=(289-2a)kJ/mol,故答案为:289-2a;
2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和=(2×630+243)-(2a+2×607)=(289-2a)kJ/mol,故答案为:289-2a;
(3)根据数据,结合正反应速率表达式为v正=k·cn(ClNO)可知,3.60×10-9mo1/(L·s)=k×(0.3mo1/L)n,1.44×10-8mo1/(L·s)=k×(0.6mo1/L)n,解得n=2,k=4.0×10-8L/(mo1·s),故答案为:2;4.0×10-8L/(mo1·s);
(4)①根据图像,T2>T1,降低温度c(C1NO)增大,说明平衡向正反应方向移动,说明正反应是放热反应,△H<0,故答案为:<;
②反应开始到10min时,c(C1NO)=1mol/L,则v(C1NO)=![]() =0.1mol/(L·min),则NO的平均反应速率v(NO)=v(C1NO)=0.1mol/(L·min),故答案为:0.1;
=0.1mol/(L·min),则NO的平均反应速率v(NO)=v(C1NO)=0.1mol/(L·min),故答案为:0.1;
③ 2NO(g)+Cl2(g)![]() 2ClNO(g)
2ClNO(g)
起始(mol/L) 2 1 0
反应 1 0.5 1
平衡 1 0.5 1
T2时该反应的平衡常数K=![]() =
=![]() =2,故答案为:2;
=2,故答案为:2;
(5)n(NO)/n(C12)的比值越小,NO的转化率越大,NO的转化率最大的是A点,根据曲线的变化趋势,当n(NO)/n(C12)=1.5,达到平衡状态ClNO的体积分数是D,故答案为:A;D;


科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则在X极附近观察到的现象是________________________________,Y电极上的电极反应式为_______________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的电极反应式是______________________,Y电极的材料是_______。
(3)如要用电解方法实现铁上镀银,电解液a选用_________溶液,则X电极的材料是_______,Y电极的电极反应式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。(已知:S2O32-+2H+=H2O+S↓+SO2↑)

(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是_______________;除如图装置所示的实验用品、仪器外,还需要的意见实验仪器是__________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是________________________。
(3)试简述测定该反应的化学反应速率的其他方法:__________________(写一种)。
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(4)该实验进行的目的是_____________淀粉溶液的作用是____________。
(5)表中Vx=_______mL,比较t1、t2、t3大小,试推测该实验结论: ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软性隐形眼镜是由甲基丙烯酸羟乙酯[CH2=C(CH3)COOCH2CH2OH]的高聚物HEMA制成的超薄镜片,其合成路线可以是:

已知:① ![]()
② CH3COOCH2CH2OH的名称为乙酸羟乙酯。试写出:
(1)A、E的结构简式分别为:A 、E 。
(2)写出下列反应的反应类型:C→D ,E→F 。
(3)写出下列转化的化学方程式:
I→G ;
G+F→H 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因是 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断
提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:w.w.w..c.o.mⅠ.2Li+H2![]() 2LiH Ⅱ.LiH+H2O=LiOH+H2↑
2LiH Ⅱ.LiH+H2O=LiOH+H2↑
①反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品。
(已知:Ksp(MnCO3)=2.2×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp[Al(OH)3]=1.3×10-33,Ksp[Fe(OH)3]=4.0×10-38)
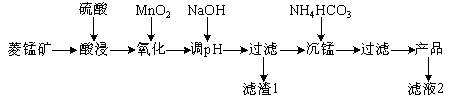
(1)滤渣1中,含铁元素的物质主要是 (填化学式,下同);加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中 含量减少。
(2)滤液2中,+1价阳离子除了H+外还有 (填离子符号)。
(3)取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8溶液,加热,Mn2+被氧化为MnO,反应一段时间后再煮沸5 min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液V mL。
①Mn2+与(NH4)2S2O8反应的还原产物为 (填化学式)。
②“沉锰”前溶液中c(Mn2+)= mol·L-1。
(4)其他条件不变,“沉锰”过程中锰元素回收率与NH4HCO3初始浓度(c0)、反应时间的关系如下图所示。

①NH4HCO3初始浓度越大,锰元素回收率越 (填“高”或“低”),简述原因 。
②若溶液中c(Mn2+)=1.0 mol·L-1,加入等体积1.8 mol·L-1 NH4HCO3溶液进行反应,计算20~40 min内v(Mn2+)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“司乐平”是治疗高血压的一种临床药物,其有效成分M的结构简式如图所示。

(1)下列关于M的说法正确的是______(填序号)。
a.属于芳香族化合物 b.遇FeCl3溶液显紫色
c.能使酸性高锰酸钾溶液褪色 d.1molM完全水解生成2mol醇
(2)肉桂酸是合成M的中间体,其一种合成路线如下:

①烃A的名称为______。步骤I中B的产率往往偏低,其原因是__________。
②步骤II反应的化学方程式为______________。
③步骤III的反应类型是________。
④肉桂酸的结构简式为__________________。
⑤C的同分异构体有多种,其中苯环上有一个甲基的酯类化合物有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯是一种用途广泛的有机原料,可制备多种化工产品。
(一)制备苯乙烯(原理如反应I所示):

(1)部分化学键的键能如下表所示:

根据反应I的能量变化,计算x= ____。
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气。用化学平衡理论解释通入水蒸气的原因为____ 。
(3)从体系自由能变化的角度分析,反应I在____(填“高温”或“低温”)下有利于其自发进行。
(二)制备α-氯乙基苯(原理如反应II所示):

(4)T℃时,向10 L恒容密闭容器中充人2mol乙苯(g)和2 mol Cl2(g)发生反应Ⅱ,5 min时达到平衡,乙苯和Cl2、α-氯乙基苯和HCl的物质的量浓度(c)随时间(t)变化的曲线如图l所示:

①0—5 min内,以HCl表示的该反应速率v(HCl)=_____________。
②T℃时,该反应的平衡常数K=_____________。
③6 min时,改变的外界条件为_____________。
④10 min时,保持其他条件不变,再向容器中充人1moI乙苯、1 mol Cl2、1 mol α-氯乙基苯和l mol HCl,12 min时达到新平衡。在图2中画出10-12 min,Cl2和HCl的浓度变化曲线(曲线上标明Cl2和HC1);0—5 min和0—12 min时间段,Cl2的转化率分别用α1、α2表示,则αl α2(填“>”、“<”或“=”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com