
【题目】某化合物易溶于水,但其水溶液不导电,则该化合物是
A.弱电解质B.强电解质C.非电解质D.不能确定其类型
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】有关乙烯分子中的化学键描述正确的是
A. 碳原子的三个sp2杂化轨道与其它原子形成三个σ键
B. 每个碳原子的未参加杂化的2p轨道形成σ键
C. 每个碳原子的sp2杂化轨道中的其中一个形成π键
D. 碳原子的未参加杂化的2p轨道与其它原子形成σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4·H2O(水合肼)极毒且不稳定,100℃以上易分解失水,常用作还原剂和除氧剂(通常生成N2和H2O),其熔点为-40℃,沸点118.5℃。现以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O和无水Na2SO3,其主要流程如下:
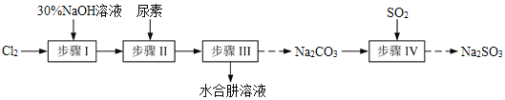
已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(aq) △H<0
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒、烧杯外,还需要_____________(填标号)。
A.容量瓶 B.胶头滴管 C.玻璃棒 D.锥形瓶
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液充分反应生成NaClO3和NaCl。实验中为控制反应温度除了用冰水浴、充分搅拌外,还需采取的措施是_______________________。
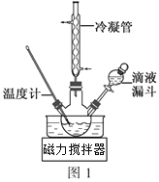
(3)步骤Ⅱ合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________(填字母);
a.尿素溶液 b.NaClO碱性溶液 c.尿素溶液或NaClO溶液任选其一
理由是____________________________________。
(4)步骤Ⅲ中分离出N2H4·H2O应该采用的方法最合理是____________________。
(5)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
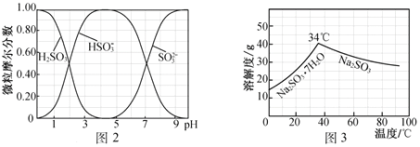
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的方法是______________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:_________________________________,用少量无水乙醇洗涤,干燥,密封包装。
(6)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:
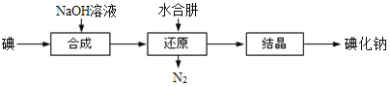
还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习中常用类推方法,下列类推正确的是![]()
![]()
A. ![]() 为直线形分子,
为直线形分子,![]() 也为直线形分子
也为直线形分子
B. 固态![]() 是分子晶体,固态
是分子晶体,固态![]() 也是分子晶体
也是分子晶体
C. ![]() 中N原子是
中N原子是![]() 杂化,
杂化,![]() 中B原子也是
中B原子也是![]() 杂化
杂化
D. ![]() 能溶于NaOH溶液,
能溶于NaOH溶液,![]() 也能溶于NaOH溶液
也能溶于NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确有( )个
①常温常压下,28gC2H4和C4H8的混合物中一定含有6NA个原子
②0℃,101kPa,22.4LCl2通入足量的NaOH溶液充分反应,有2NA个电子转移
③常温下,pH=12的氢氧化钠溶液中OH-数目为0.01NA
④1L1.0mol/LFeCl3溶液全部水解制备氢氧化铁胶体,所得氢氧化铁胶体数目为NA
⑤同温同压下,O2和CO组成的混合气体的密度是氢气的15倍,则O2和CO的体积比1:1
⑥常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA
⑦lmolSO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
⑧100克质量分数为46%的乙醇溶液中,含有的氧原子数目为4NA
⑨标准状况下,22.4LHF气体中含有NA个气体分子
A. 4 B. 1 C. 2 D. 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )

A. 溶液中K+向电极b移动
B. 反应消耗的NH3与O2的物质的量之比为4:5
C. 氨气在电极a上发生氧化反应
D. 正极的电极反应式为:O2+4e﹣+2H20=4OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH![]() 、Cl-、Mg2+、Ba2+、CO
、Cl-、Mg2+、Ba2+、CO![]() 、SO
、SO![]() ,现取三份100 mL该溶液进行如下实验:
,现取三份100 mL该溶液进行如下实验:
(1) 第一份加入AgNO3溶液有沉淀产生;
(2) 第二份加足量NaOH溶液加热后,收集到气体0.04 mol;
(3) 第三份加足量BaCl2溶液后,干燥后得沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( )
①K+一定存在;②100 mL溶液中含0.01 mol CO![]() ;③Cl-可能存在;
;③Cl-可能存在;
④Ba2+一定不存在;⑤Mg2+可能存在
A. ③④ B. ③④⑤
C. ①② D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
A. ![]() 、
、![]() 、
、![]() 中,所有原子都满足最外层8电子的稳定结构
中,所有原子都满足最外层8电子的稳定结构
B. 在元素周期表中金属和非金属交界处可以找到半导体材料
C. 由非金属元素组成的化合物一定是共价化合物
D. 第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g)![]() CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
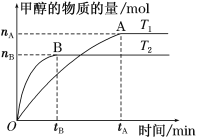
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com