
在一密闭容器中盛有2molNa2O2与2molNaHCO3,将其加热到150℃,经充分反应后,容器内残留的固体是
| A.1molNa2CO3和2molNaOH | B.2molNa2CO3和2molNaOH |
| C.2molNa2CO3和1molNa2O2 | D.只有2molNa2CO3 |
B
解析试题分析:在加热的条件下碳酸氢钠分解生成碳酸钠、水和CO2,方程式为:
2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
2mol 1mol 1mol 1mol
由于氢氧化钠能吸收CO2生成碳酸钠,因此一定量的Na2O2与一定量的CO2和H2O(g)的混合物的反应,可看做Na2O2先与CO2反应,待CO2反应完全后,Na2O2再与H2O(g)发生反应。则根据方程式可知:
2Na2O2+2CO2=2Na2CO3+O2
2mol 2mol 2mol
1mol 1mol 1mol
2Na2O2+2H2O=4NaOH+O2↑
2mol 2mol 4mol
1mol 1mo 2mol
因此经充分反应后,容器内残留的固体是2molNa2CO3和2molNaOH,答案选B。
考点:考查过氧化钠与碳酸氢钠混合物加热反应生成物的判断


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:单选题
将铜粉放入稀硫酸中,加热无明显变化,但加入某盐后发现铜粉质量明显减少,则该盐不可能是
| A.Fe2(SO4)3 | B.NaCl | C.KNO3 | D.Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于Fe2+和Fe3+的叙述中。错误的是
| A.Fe2+的水溶液为浅绿色 |
| B.Fe3+的水溶液为黄色 |
| C.Fe3+具有氧化性,Fe2+具有还原性 |
| D.Fe3+溶液中滴入含SCN-的溶液,立即出现红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2003年诺贝尔化学奖授予了美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成就。Mackinnon教授的研究内容主要是Na+、K+体积很接近,但在生物体内呈现的差别却高达1万倍,他革命性的让科学家观测Na+、K+在进入离子通道前、通道中以及穿过通道后的状态,可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是
| A.单质钠的密度比钾的密度小 |
| B.Na+和K+常用作氧化剂 |
| C.钠和钾都是短周期元素 |
| D.钠和钾的合金[ω(K)=50%~80%]在室温下呈液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为 ( )
A. (a+b) mol (a+b) mol | B.(a-b) mol | C. (a-b)mol (a-b)mol | D.(a+b) mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将Cu片放入0.1 mol/L FeCl3溶液中,反应一定时间后取出Cu片,溶液中C(Fe3+):C(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为 ( )
| A.3:2 | B.3:5 | C.4:3 | D.3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
工业上焙烧明矾[ KAl(SO4)2·12H2O]的化学方程式为:
4 KAl(SO4)2·12H2O+3S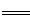 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
| A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4 |
| B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-) |
| C.焙烧产生的SO2可用于制硫酸,焙烧948 t明矾(M=" 474" g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432 t |
| D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 |
 NaAlO2+3Ni(OH)2
NaAlO2+3Ni(OH)2查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各图与表述一致的是
| A.图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 |
| B.图②b曲线表示反应CH2=CH2(g)+H2(g)→CH3-CH3(g)ΔH <0,使用催化剂时,反应过程中的能量变化 |
| C.曲线图③可以表示向一定量的氢氧化钠溶液中滴加一定浓度氯化铝溶液时产生沉淀的物质的量变化 |
| D.图④电解饱和食盐水的装置中阴极的电极反应式为:2H++ 2e- = H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成。将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压下测定)有剩余气体。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是
①粉末中一定有Na2O、Na2O2、NaHCO3
②粉末中一定不含有Na2CO3和NaCl
③粉末中一定不含有Na2O和NaCl
④无法肯定粉末中是否含有Na2CO3和NaCl
| A.①② | B.②③ | C.③④ | D.①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com