
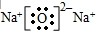 ,
,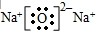 ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、苯的硝化、丙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 |
| B、C8H10含苯环的烃同分异构体有3种 |
| C、乙烯、苯、乙烷分子中的所有原子都在同一平面上 |
D、莽草酸( )能使溴的四氯化碳溶液褪色 )能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | |
| W |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A.B.C.D.E是元素周期表中五种短周期元素,请根据表中信息回答下列问题
A.B.C.D.E是元素周期表中五种短周期元素,请根据表中信息回答下列问题| 元素 | A | B | C | D | E |
| 性质或结 构信息 | 形成化合物种类最多的元素 | 最高正价是最低负价绝对值的3倍 | 族序数等于周期数的3倍 | 周期数是族序数的3倍 | 最高价氧化物对应水化物是最强的含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol |
| B、0.2mol |
| C、0.25mol |
| D、0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L 的H2S溶液中:c(OH-)+c(HS-)+c(S2-)=c(H+) |
| B、向 NaHSO3溶液中加入NaOH溶液,c(OH-)/c(H+)和c(HSO3-)/c(SO32-)的比值均增大 |
| C、将一定量氨气通入0.1mol/L NH4Cl溶液中有可能:c(H+)-c(OH-)>c(NH3?H2O) |
| D、向0.2mol/L NaHCO3溶液中加入等体积0.1mol/L NaOH溶液:c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com