


科目:高中化学 来源: 题型:

| ||
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液(mL) | 25.00 | 25.02 | 26.20 | 24.98 |

查看答案和解析>>
科目:高中化学 来源: 题型:

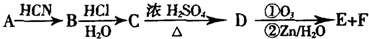
查看答案和解析>>
科目:高中化学 来源: 题型:
| M |
| M |
| 选 项 | X | Y | Z | M |
| A | NH3 | NO | NO2 | O2 |
| B | NaOH | Na2SO3 | NaHSO3 | SO2 |
| C | Al2O3 | NaAlO2 | Al(OH)3 | NaOH |
| D | Mg | C | CO | CO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、地下钢管连接镁块 |
| B、金属护拦表面涂漆 |
| C、枪炮表面涂上一层油 |
| D、水中的钢闸门连接电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与盐酸反应 CO32-+2H+═CO2↑+H2O |
| B、硫酸和氯化钡溶液反应 Ba2++SO42-═BaSO4↓ |
| C、氢氧化钠和足量二氧化碳反应 2OH-+CO2═CO32-+H2O |
| D、铁钉放入硫酸铜溶液中 Fe+3Cu2+═2Fe3++3Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
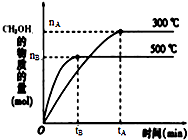 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小于0.2mol |
| B、0.2mol |
| C、0.4mol |
| D、0.2mol和0.4mol之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
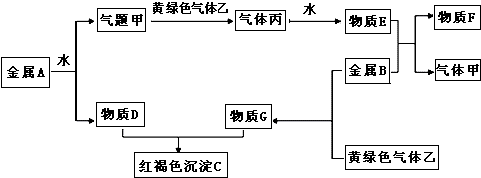
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com