
【题目】下列各物质是中学化学中常见的物质,甲为常见金属单质,丙为黄绿色的单质气体,乙、丁是常见无色气态非金属单质,其它均为化合物,C常温下为一种液体,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,F为棕黄色溶液。①是实验室制取丁的反应之一。各物质间的转化如下图所示,回答下列问题(部分生成物未列出):

(1)物质I的化学式为________;
(2)在反应①中,当生成标准状况下丁气体4.48L时,反应转移的电子数约为___________;
(3)B与K的反应是实验室制取丙的反应,其离子方程式为________________;
(4)反应②的化学方程式为_____________;
(5)若E与G以物质的量比为1:1投入足量水中,反应的离子方程式为________;
(6)写出实验室检验F中阴离子的方法_____________。
【答案】Fe(OH)3 2.408×1023 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 3Fe + 4H2O(g)
Mn2++Cl2↑+2H2O 3Fe + 4H2O(g) ![]() Fe3O4 +4H2 4Fe2++4Na2O2 + 6H2O = 4Fe(OH)3↓+8Na+ + O2↑ 取少量F溶液于试管中,加入少量AgNO3溶液,若产生白色沉淀且加稀HNO3不溶解,则有Cl-
Fe3O4 +4H2 4Fe2++4Na2O2 + 6H2O = 4Fe(OH)3↓+8Na+ + O2↑ 取少量F溶液于试管中,加入少量AgNO3溶液,若产生白色沉淀且加稀HNO3不溶解,则有Cl-
【解析】
甲为常见金属单质,丙为黄绿色的单质气体,再根据E、F的转化关系得出甲为Fe,丙为Cl2,乙是无色气态非金属单质,C常温下为一种液体,B、D分别为黑色粉末和黑色晶体,说明C为水,D为四氧化三铁,乙为氢气,K为盐酸,E为氯化亚铁,F为氯化铁,G为淡黄色固体,I为红褐色固体,G为过氧化钠,I为氢氧化铁,J为生活中常见的调味品即为氯化钠,丁为氧气,①是实验室制取丁的反应之一,说明A为过氧化氢,B为二氧化锰。
⑴根据上面分析得到物质I的化学式为Fe(OH)3;故答案为:Fe(OH)3。
⑵在反应①中,2H2O2 ![]() 2H2O + O2↑,2mol转移2mol电子生成1mol氧气,当生成标准状况下丁气体4.48L即0.2mol,反应转移的电子物质的量为0.2mol,数目约为2.408×1023;故答案为:2.408×1023。
2H2O + O2↑,2mol转移2mol电子生成1mol氧气,当生成标准状况下丁气体4.48L即0.2mol,反应转移的电子物质的量为0.2mol,数目约为2.408×1023;故答案为:2.408×1023。
⑶二氧化锰与浓盐酸的反应是实验室制取丙的反应,其离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
⑷反应②的化学方程式为3Fe + 4H2O(g) ![]() Fe3O4 +4H2;故答案为:3Fe + 4H2O(g)
Fe3O4 +4H2;故答案为:3Fe + 4H2O(g) ![]() Fe3O4 +4H2。
Fe3O4 +4H2。
⑸若E与G以物质的量比为1:1投入足量水中,反应的离子方程式为4Fe2++4Na2O2 + 6H2O = 4Fe(OH)3↓+8Na+ + O2↑;故答案为:4Fe2++4Na2O2 + 6H2O = 4Fe(OH)3↓+8Na+ + O2↑。
⑹实验室检验F中阴离子的方法取少量氯化铁溶液于试管中,加入少量AgNO3溶液,若产生白色沉淀且加稀HNO3不溶解,则有Cl-;故答案为:少量氯化铁溶液于试管中,加入少量AgNO3溶液,若产生白色沉淀且加稀HNO3不溶解,则有Cl-。


科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①②B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3)配制100mL1.0mol·L-1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)需量取浓硫酸的体积为_______mL。
(2)实验时选用的仪器有(填序号)_______。
(3)配制过程中,下列情况会使配制结果偏高的是________(填序号) 。
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)_______。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种历史悠久的解热镇痛药.下列有关说法正确的是( )
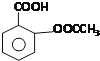
A.与乙酰水杨酸具有相同官能团的芳香族同分异构体共有8种![]() 不考虑立体异构
不考虑立体异构![]()
B.乙酰水杨酸的所有原子均在同一平面上
C.乙酰水杨酸能发生取代、加成、氧化、还原反应
D.乙酰水杨酸易溶于水、乙醇等溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K 和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_____________________。
(2)该反应为____________反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_____________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 _________。
(5)1200℃时,在2L的密闭容器中,反应开始时加入1mol CO2、1mol H2、2molCO、2mol H2O,则反应向__________进行(填“正方向”、“逆方向”或“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2CO3·10H2O晶体配制0.2mol·L-1Na2CO3溶液230mL。
(1)实验时要用到的玻璃仪器有:除托盘天平、量筒、烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是__________,在使用该仪器前必须进行的操作是_______。
(2)应用托盘天平称取Na2CO3·10H2O晶体的质量为___________g。
(3)配制溶液时有多个操作,请简述定容的过程:________。
(4)配制过程中,下列操作会引起所配溶液的浓度偏大的有____(填序号)。
a.Na2CO3·10H2O晶体不纯,混有NaCl
b.用“左码右物”的称量方法称量晶体
c.容量瓶中洗净后未干燥,残留少量水
d.未冷却至室温就转移定容
e.加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出
f.定容时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述不正确的是
A.100mL0.1mol·L-1Na2CO3溶液中含有0.01NA个CO32-
B.0.24g Mg在O2和CO2的混合气体中完全燃烧,转移电子数为0.02NA
C.14g乙烯和14g丙烯含有的C-H的数目都是2NA
D.已知在密闭容器中发生反应![]() △H=-196.6 kJ·mol-1,若放出98.3kJ的热量,则消耗0.5NA个O2分子
△H=-196.6 kJ·mol-1,若放出98.3kJ的热量,则消耗0.5NA个O2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.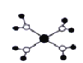 四水合铜离子([Cu(H2O)4]2+)的模型如图所示,铜离子与水分子的氧原子形成4个配位键
四水合铜离子([Cu(H2O)4]2+)的模型如图所示,铜离子与水分子的氧原子形成4个配位键
B.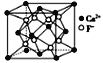 CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图所示,电子云密度大的区域电子数目多
H原子的电子云图如图所示,电子云密度大的区域电子数目多
D.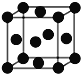 金属Cu的晶胞结构如图所示,晶胞中Cu原子的配位数为12
金属Cu的晶胞结构如图所示,晶胞中Cu原子的配位数为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇广泛存在于食物(例如桑甚、花生,尤其是葡萄)中,它可能具有抗癌性。能够与1 mol该化合物发生反应的Br2和H2的最大用量分别是( )
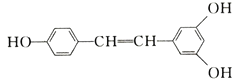
A.1mol、1molB.3.5mol、7mol
C.3.5mol、6molD.6mol、7mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com