
【题目】碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再进行测定。
(1)在高温下将x克钢样中碳、硫转化为CO2、SO2(气体a)。
(2)将气体a通入测硫装置中(如图1),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式:___________ ______。
②将①的吸收液稀释至250mL,取1/10该溶液进行滴定,用酸式滴定管取液时赶走气泡的操作是_ 。
③用c mol/L 标准 NaOH 溶液滴定取出的溶液,则选择的指示剂为_________,直至加入最后一滴NaOH溶液时,溶液颜色_________,即可停止滴定。
④某次滴定前后,NaOH 溶液的液面如图2,其体积读数为________________________。若滴定3次,消耗NaOH溶液体积的平均值为z mL,则该钢样中硫的质量分数为______________________(用 x、c、z表示)。
⑤下列操作会造成测定结果偏高的是__________。
a.水洗后未用标准液润洗碱式滴定管 b.加入1 mL酸碱指示剂
c.滴定终点时,尖嘴出现气泡 d.滴定终点俯视滴定管的刻度

将气体 a 通入测碳装置中(如图),采用重量法测定碳的含量。
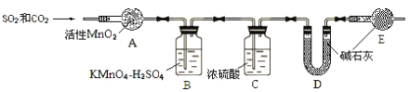
⑥为准确测定CO2,需除去SO2的干扰,除去SO2的装置是_______(填序号)。
⑦计算钢样中碳的质量分数,应测量的数据是__________。去掉装置E,测得碳的质量分数 (填 “偏小”、“无影响”或“偏大”)
⑧上述操作中,测定CO2前先除去SO2,但测定SO2前却没除CO2,是否合理?若不合理,说明如何改正;若合理,说明理由_____________________。
【答案】(2)① SO2+H2O2=H2SO4(2分);②快速放液(1分);
③酚酞(1分)恰好使溶液由无色变为浅红色,且半分钟内不褪色(1分);
④24.50 mL(2分);16cz/x %(2分);
⑤ ab(1分);⑥A、B(1分);
⑦装置 D 吸收气体前后的质量(1分) 偏大(1分);
⑧合理(1分),SO2被氧化成硫酸后,溶液中的 c(H+)增大,使 CO2 的溶解平衡向逆向移动,导致 CO2 在水中几乎不溶,不会对测定SO2 产生影响。CO2 和 SO2 都能被碱石灰吸收,因此测定 CO2 时必须除去 SO2(2分)。
【解析】
试题分析:(2)①H2O2具有氧化性,SO2具有还原性,二者发生氧化还原反应常数硫酸,H2O2氧化SO2的化学方程式是SO2+H2O2=H2SO4;
②将①的吸收液稀释至250mL,取1/10该溶液进行滴定,用酸式滴定管取液时赶走气泡的操作是快速放液,使气泡随液流赶出;
③用c mol/L标准NaOH溶液滴定取出的硫酸溶液,根据视觉的滞后性,为减小实验误差,应该选择的指示剂为酚酞;开始酚酞在酸溶液中,为无色,随着NaOH的加入,溶液的碱性逐渐增强,当加入最后一滴 NaOH 溶液时,溶液颜色由无色变为浅红色,且半分钟内不褪色,即可停止滴定;
④滴定前液面在0.30mL,滴定结束时液面在24.80mL,则反应消耗NaOH标准溶液的体积是24.80mL-0.30mL=24.50mL,若滴定3次,消耗NaOH溶液体积的平均值为 z mL,则根据元素守恒可知n(NaOH)=2n(H2SO4)=2n(S),n(NaOH)= cz×10-3 mol,则n(S)=1/2 n(NaOH)= 5×cz×10-4 mol,该钢样中硫的质量分数为[(5×cz×10-4 mol×32g/mol)÷0.1x]×100%=16cz/x%;
⑤a.水洗后未用标准液润洗碱式滴定管,使NaOH标准溶液的浓度偏低,导致消耗标准溶液的体积偏大,则使测定的硫酸的浓度偏大,正确;b.加入 1mL酸碱指示剂,由于指示剂偏大,会使反应消耗的NaOH标准溶液的体积偏多,据此计算的硫酸的浓度偏高,正确;c.滴定终点时,尖嘴出现气泡,则NaOH溶液的体积偏少,会使计算的硫酸的浓度偏低,错误;d.滴定终点俯视滴定管的刻度, 使反应消耗的NaOH标准溶液的体积偏少,据此计算的硫酸的浓度偏低,错误。答案选ab;
⑥SO2具有还原性,可以被氧化剂MnO2、KMnO4氧化产生硫酸,而CO2不能发生反应,因此除去CO2中的SO2杂质的装置是AB;
⑦计算钢样中碳的质量分数,应测量的数据是钢样品的质量及装置D吸收气体前后的质量。若去掉装置 E,空气中的水、二氧化碳会被E吸收,也会将它们当作CO2,故使测得碳的质量分数偏大;
⑧上述操作中,测定CO2前先除去SO2,因为CO2和SO2都能被碱石灰吸收,因此测定CO2时必须除去SO2;但测定SO2前却没除CO2,是因为SO2被氧化成硫酸后,溶液中的c(H+)增大,使CO2的溶解平衡:CO2+H2O=H2CO3![]() H++HCO3-向逆反应方向移动,导致CO2在水中几乎不溶,因此不会对测定SO2产生影响。
H++HCO3-向逆反应方向移动,导致CO2在水中几乎不溶,因此不会对测定SO2产生影响。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在固定容积为2L的密闭容器中,800℃时,发生反应2NO(g)+O2(g)![]() 2NO2(g), n(NO)随时间的变化如下表:
2NO2(g), n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
N(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
下列说法错误的是
A. 若使用合适的正催化剂反应到达平衡的时间少于3s
B. 0 ~2 s内O2的平均反应速率为0.003mol/(L·s)
C. 反应到第5s时,NO的转化率为65%
D. 3s后气体的颜色不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列有关该有机物的说法不正确的是( )

①分子式为C10H18O3
②可溶于水;
③分子中含有两种官能团
④可使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同
⑤能发生加成、酯化、硝化、氧化等反应
⑥所有的原子可能共平面.
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是
A. 32克O2和O3组成的混合气体中含有的氧原子数目为2NA
B. 常温常压下,22.4 L乙醇含有的分子数目为NA
C. 1 mol Na变为Na+时得到的电子数目为NA
D. 1mol /L NaCl溶液中含有Na+个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是

A. 混合酸中NO3-物质的量为0.4mol
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氟化氢水溶液中存在的氢键有 种;分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为 ,1个分子中含有 个![]() 键;
键;
(2)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数均为 ;很多不饱和有机物在Ni催化下可以H2发生加成反应,如①CH2=CH2、②HC≡CH、③![]() 、④HCHO等,其中碳原子不是采取sp2杂化的分子有 (填物质编号),HCHO分子的立体构型为 。
、④HCHO等,其中碳原子不是采取sp2杂化的分子有 (填物质编号),HCHO分子的立体构型为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝制品比铁制品在空气中不易被锈蚀,原因是( )
A.铝的金属性比铁弱
B.铝的密度比铁的密度小
C.铝在空气中易与氧气形成一层致密的氧化膜
D.铝不能与氧气发生化学反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com