
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)![]() zC(g)。平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断错误的是 ( )
zC(g)。平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断错误的是 ( )
A. x+y<z B. 平衡向逆反应方向移动
C. B的转化率降低 D. C的体积分数下降
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol/L NaOH溶液滴定0.10mol/L HA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示,下列叙述错误的是

A. 当滴定至溶液呈中性时,c(A-)>c(HA)B. N点,c(Na+)·c(A-)=![]()
C. Ka(HA)的数量级为10-5D. P-Q过程中,水的电离程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Fe3+ +Ag ![]() Fe2+ +Ag+ (K=1.8)设计成下图所示原电池(盐桥中装有琼脂——KNO3溶液)。在本题中灵敏电流计指针偏转方向即电子流动方向。
Fe2+ +Ag+ (K=1.8)设计成下图所示原电池(盐桥中装有琼脂——KNO3溶液)。在本题中灵敏电流计指针偏转方向即电子流动方向。
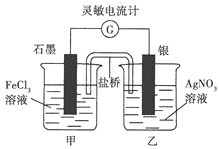
开始接通导线时灵敏电流计指针向左偏转,一段时间后电流计指针指向中间“0”刻度。然后进行如下实验:
(1)向A烧杯中滴加浓FeCl3溶液,指针___(填“向左”、“向右”或“不偏转”);
(2)向B烧杯中滴加少量Na2S溶液,指针__(填“向左”、“向右”或“不偏转”),原因为___。
(3)下图所示原电池的负极是_____,负极的电极反应式是____________,写出该反应的离子方程式________________________,该反应的平衡常数等于____________。(Ksp(AgCl)=1.8×10-10)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组的同学验证文献上用乙烯气脱除氮氧化物。回答下列问题:
(1)甲组同学设计实验制取纯净的乙烯气体和NO。
①设计的制备C2H4装置如图所示:

资料:C2H5OH![]() CH2=CH2↑+H2O(主)
CH2=CH2↑+H2O(主)
C2H5OH+2H2SO4(浓)![]() 2C+2SO2↑+5H2O(副)
2C+2SO2↑+5H2O(副)
C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O(副)
CO2↑+2SO2↑+2H2O(副)
写出乙烯的电子式___________
装置B中盛放的试剂为___________(填小写字母)。
a KMnO4溶液 b Br2/CCl4溶液 c 浓NaOH溶液 d 浓硫酸
②设计图装置制备NO气体

装置D烧瓶中的实验现象为:___________;
装置E盛放的试剂是___________。
(2)乙组利用甲组制得的C2H4和NO并选用下列装置进行催化反应,并检验乙烯的氧化物CO和CO2(部分装置可重复使用,已知C2H4可被热的CuO氧化为碳的氧化物,酸性高锰酸钾可氧化NO和C2H4,不氧化CO)。

①各装置的连接顺序为:
![]() →K→G→___________→H→G→___________→M。(按顺序填一个或多个字母)
→K→G→___________→H→G→___________→M。(按顺序填一个或多个字母)
②K后接的G的作用是___________。
③酸性高锰酸钾溶液的作用是___________。
④证明乙烯的氧化产物中有CO的现象是___________;
若NO还原为N2,乙烯氧化为等物质的量的CO和CO2,则反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26次会议新修订了阿伏加德罗常数(Na = 6. 022214076×l023mol-1),并于2019年5月20日正式生效。下列说法不正确的是
A. 标准状况下11. 2 L的CH3Cl中含有氢原子的数目为1. 5NA
B. lmol Na2O2固体中含有阴、阳离子的总数目为3NA
C. l00mL lmolL-1 NH4Cl溶液中含有阳离子的数目大于0.1 NA
D. 18gD2O和H2O的混合物中含有的中子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B. 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C. pH=12的溶液:K+、Na+、CH3COO-、Br-
D. 25℃时,由水电离产生的c(H+)为 1![]() 10-9的溶液中:Mg2+、Cu2+、SO32-、NO3-
10-9的溶液中:Mg2+、Cu2+、SO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2混合气体,2 min后,反应达到平衡,生成SO3气体0.5 mol,同时放出热量Q kJ。回答下列问题
(1)写出该反应的热化学方程式为______________________________________。
(2)在该条件下,反应前后容器的体积之比为______________。
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)______0.5mol(填 “大于”、“小于”或“等于”);
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量_______Q kJ(填 “大于”、“小于”或“等于”)。
II. 用焦炭还原NO2的反应为:2NO2(g)+2C(s )![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

(1)A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B) (填 “﹥”、“<”或“﹦”)。
(2)A、B、C三点中NO2的转化率最高的是_____(填“A”或“B”或“C”)点。
(3)计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物环丙叉环丙烷(![]() )具有特殊结构,倍受化学家关注.下列关于该化合物的说法错误的是
)具有特殊结构,倍受化学家关注.下列关于该化合物的说法错误的是
A. 与苯互为同分异构体B. 二氯代物超过两种
C. 所有碳原子均处于同一平面D. 生成1molC6H14至少需要3molH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com