
【题目】国际计量大会第26次会议新修订了阿伏加德罗常数(Na = 6. 022214076×l023mol-1),并于2019年5月20日正式生效。下列说法不正确的是
A. 标准状况下11. 2 L的CH3Cl中含有氢原子的数目为1. 5NA
B. lmol Na2O2固体中含有阴、阳离子的总数目为3NA
C. l00mL lmolL-1 NH4Cl溶液中含有阳离子的数目大于0.1 NA
D. 18gD2O和H2O的混合物中含有的中子数为9NA
【答案】D
【解析】
A.标准状况下,11.2L的一氯甲烷的物质的量为![]() ,含有1.5mol氢原子,含有氢原子的数目为1. 5NA,A正确;
,含有1.5mol氢原子,含有氢原子的数目为1. 5NA,A正确;
B.过氧化钠为离子化合物,由钠离子(Na+)和过氧根离子(O22-)组成,1molNa2O2固体中含有阴、阳离子的总数目为3NA,B正确;
C.铵根离子在溶液中会水解,NH4++H2ONH3·H2O+H+,水解的NH4+数目等于水解产生的H+,在溶液中还存在H2OH++OH-,所以 l00mL lmolL-1 NH4Cl溶液中含有阳离子的数目大于0.1 NA,C正确;
D.假设18g全为D2O,则中子数为![]() ,假设18g全为H2O,则中子数为
,假设18g全为H2O,则中子数为![]() ,所以18gD2O和H2O的混合物中含有的中子数不一定为9NA,D错误;
,所以18gD2O和H2O的混合物中含有的中子数不一定为9NA,D错误;
答案:D。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,如图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。
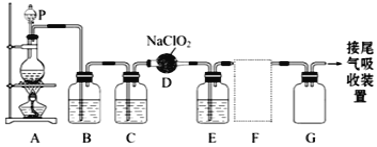
(1)仪器P的名称是___。
(2)实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应,写出D中发生反应的方程式:___。
(3)B装置中所盛的试剂是___。
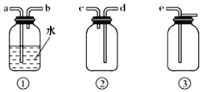
(4)F为ClO2收集装置,应选用的装置是___(填序号),其中与E装置导管相连的导管口是___(填接口字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四碘化锡(Snl4,M=627g/mol)是一种橙色针状晶体,遇水易发生水解,可在非水溶剂中由Sn和l2直接化合得到,实验装置如图(1)(加热装置略去)所示。

实验步骤如下:
组装仪器并加入药品后,通入冷凝水,加热圆底烧瓶,控制反应温度在80℃左右,保持回流状态,直到反应完全。取下仪器A、B,趁热将溶液倒入干燥的烧杯中,用热的CCl4洗涤圆底烧瓶内壁和锡片,并将洗涤液合并入烧杯内。再将烧杯置于冷水浴中冷却即析出Snl4晶体。
请回答下列问题:
(1)仪器B的名称为___________,冷凝水的进口为____________(填“甲”或“乙”)。为了控制反应温度,对圆底烧瓶适宜的加热方式是____________________。
(2)仪器A中盛放的试剂为无水CaCl2,其作用为____________。
(3)反应完全的现象为__________,用热的CCl4洗涤圆底烧瓶内壁和锡片的目的是_______,从烧杯中获取产品的操作名称为______________。
(4)产品的纯度可用滴定法测定:称取m g产品,加入足量的水,使产品充分水解[SnI4+(2+x)H2O=SnO2·xH2O↓+4HI]。将上层清液全部定容于250mL容量瓶中。移取25.00mL于锥形瓶中,加入少量CCl4和几滴KSCN溶液,用c mol/L的标准FeCl3溶液滴定至终点,平行测定三次,平均消耗标准FeCl3溶液的体积为1mL。(已知:2Fe3++2I-![]() 2Fe2++I2)
2Fe2++I2)
①下列关于滴定分析,不正确的是________。
a.图(2)中为避免滴定管漏液,应将凡士林涂在旋塞的a端和旋塞套内的c端
b.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶的内壁
c.当下层溶液变为紫红色且半分钟不褪色即为滴定终点
d.若不加CCl4,则测得样品的纯度可能偏高
②产品纯度的表达式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2一氨-3—氯苯甲酸是白色晶体,其制备流程如下:
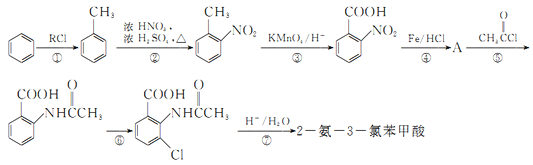
已知:
回答下列相关问题
(1)![]() 的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
(2)反应①中R代表的是_____________,反应②的反应类型为_____________。
(3)如果反应③中KMnO4的还原产物为MnSO4,请写出该反应的化学方程式_____________。
(4)A的结构简式为_____________,⑥的反应条件为_____________。
(5)符合下列条件的同分异构体的结构简式为_____________。
a.式量比![]() 大42的苯的同系物;
大42的苯的同系物;
b.与酸性KMnO4反应能生成二元羧酸
c.仅有3种等效氢
(6)事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。
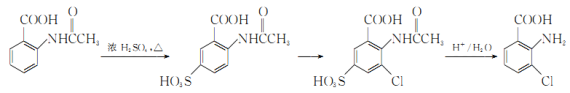
分析产率提高的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)![]() zC(g)。平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断错误的是 ( )
zC(g)。平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断错误的是 ( )
A. x+y<z B. 平衡向逆反应方向移动
C. B的转化率降低 D. C的体积分数下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂废酸主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+ 。利用该废液制备过二硫酸铵[( NH4) 2S2O8]和TiO2的一种工艺流程如下:

已知:i.TiOSO4在热水中易水解生成H2TiO3,相关离子形成氢氧化物沉淀的pH范围如 下表:
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii. pH>7 时,Fe2+部分生成 Fe( Ⅱ)氨络离Fe(NH3)2]2+o
请回答下列问题:
(1)加入适量Fe的作用是________________ .
(2)生成TiO(OH)2的化学方程式为_______________ 。
(3)滤渣I、滤渣II均含有的物质的化学式为_____________ .
(4)加入H2O2的目的是除掉Fe( Ⅱ)氨络离子[Fe(NH3)2]2+,此过程中氧化剂与还原剂的物质的量之比理论上等于________ (填数值)。
(5)常温下,含硫微粒主要存在形式与pH的关系如下图所示。

用Pt电极电解饱和NH4HSO4溶液制备过二硫酸铵时,为满足在阳极放电的离子主要为 HSO4-,应调节阳极区溶液的pH范围在______之间,其电极反应式为____________ 。
(6)科研人员常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定TiO2的纯度,其步骤为: 用足量酸溶解wg 二氧化钛样品,用铝粉做还原剂,过滤、洗涤,将滤液定容为100 mL,取 25.00 mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反应原理为: Ti3++Fe3+=Ti4++Fe2+。
①判断滴定终点的方法:________________________ 。
②滴定终点时消耗c mol/L-1 NH4Fe(SO4)2溶液VmL,则TiO2纯度为___________(写岀相关字母表示的代数式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴入某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如图所示[已知:![]() ]。下列叙述不正确的是
]。下列叙述不正确的是

A. Ka(HA)的数量级为10-5
B. 滴加NaOH溶液的过程中,![]() 保持不变
保持不变
C. m点所示溶液中:c(H+)+c(Na+)=c(HA)+c(OH-)
D. n点所示溶液中:c(Na+)=c(A-)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含NH4NO3废水的原理如图所示,在直流电场的作用下,两膜中间的NH4+和NO2—可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.工作一段时间后,在两极区均得到副产品NH4NO3.下列叙述正确的是

A. a极为电源负极,b极为电源正极
B. c膜是阴离子交换膜,d膜是阳离子交换膜
C. 阴极电极反应式为2NO3-+12H++10e-=N2 +6H2O
D. 当电路中通过1mol电子的电量时,会有5.6LO2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com