
【题目】三室式电渗析法处理含NH4NO3废水的原理如图所示,在直流电场的作用下,两膜中间的NH4+和NO2—可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.工作一段时间后,在两极区均得到副产品NH4NO3.下列叙述正确的是

A. a极为电源负极,b极为电源正极
B. c膜是阴离子交换膜,d膜是阳离子交换膜
C. 阴极电极反应式为2NO3-+12H++10e-=N2 +6H2O
D. 当电路中通过1mol电子的电量时,会有5.6LO2生成
科目:高中化学 来源: 题型:
【题目】国际计量大会第26次会议新修订了阿伏加德罗常数(Na = 6. 022214076×l023mol-1),并于2019年5月20日正式生效。下列说法不正确的是
A. 标准状况下11. 2 L的CH3Cl中含有氢原子的数目为1. 5NA
B. lmol Na2O2固体中含有阴、阳离子的总数目为3NA
C. l00mL lmolL-1 NH4Cl溶液中含有阳离子的数目大于0.1 NA
D. 18gD2O和H2O的混合物中含有的中子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-羟基香豆素是医药中间体,用于生产抗凝血药物,其结构简式如图所示。下列说法正确

A. 分子式为![]()
B. 所有原子一定处于同一平面
C. 苯环上的一氯代物有2种
D. 与HCl加成能生成2种同分异构体(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室测定水体中氯离子含量,实验过程如下:向水样中加入K2CrO4溶液作指示剂,用0.0010 mol·L-1AgNO3溶液滴定至终点。已知:Ag2CrO4为不溶于水的砖红色沉淀;常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)= 1.8×10-12。回答下列问题:
(1)滴定时,应使用____________(填“酸式”或“碱式”) 滴定管。
(2)滴定达到终点的标志是___________________________________________。
(3)实验过程中测得数据如下表:
编号 | 1 | 2 | 3 |
V(水样)/mL | 10.00 | 10.00 | 10.00 |
V(AgNO3)/mL | 3.75 | 4.01 | 3.99 |
计算水样中氯离子的含量为_______________mg/L(保留2位小数)
(4)滴定结束后:
①当溶液中的残余c(Cl-)=1.8×10-5mol/L,则此时溶液中c(CrO42-)=____________ mol·L-1。
②已知2AgCl+ CrO42-![]() 2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
(5)下列情况会造成实验测定结果偏低的是____________。(填标号)
A.锥形瓶洗涤后未干燥 B.滴定前,未使用标准液润洗滴定管
C.滴定管滴定前仰视读数,滴定后俯视读数
D.滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物环丙叉环丙烷(![]() )具有特殊结构,倍受化学家关注.下列关于该化合物的说法错误的是
)具有特殊结构,倍受化学家关注.下列关于该化合物的说法错误的是
A. 与苯互为同分异构体B. 二氯代物超过两种
C. 所有碳原子均处于同一平面D. 生成1molC6H14至少需要3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义.
(1)海水中无机碳的存在形式及分布如下图所示:
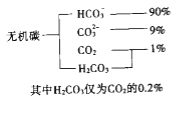
用离子方程式表示海水呈弱碱性的原因______________.已知春季海水pH=8.1,预测夏季海水碱性将会_____________(填写“增强”或“减弱”),理由是_________________________.
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)CH3OH(g) △H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇.如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.下列说法正确的是_______________.
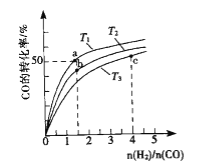
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5 mol co和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 mol co和4mol H2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
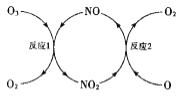
①NO的作用是___________________。
②已知:O3(g)+0(g)=202(g) △H=-143kJ·mol-l
反应1: O3(g)+NO(g)NO2(g)+O2(g) △H1=-200.2kJ·mol-l
反应2:热化学方程式为_____________________。
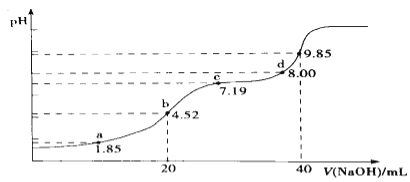
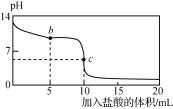
(4)大气污染物SO2可用NaOH吸收.已知pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。该温度下用0.1mol· L-1 NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如图所示.b点所得溶液中各离子浓度由大到小的顺序是________________;c点所得溶液中:c(Na+)___________3c(HSO3-)(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。
向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示[其中a点的坐标为(9.5,0.5)]。

甲 乙
下列溶液中的关系中一定正确的是
A. 图甲中pH=7的溶液:c(Cl-)=c(HCN)
B. 常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol/L
C. 图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D. 图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池结构如图所示,其中电解质![]() 溶于混合有机溶剂中,
溶于混合有机溶剂中,![]() 通过电解质迁移入
通过电解质迁移入![]() 晶格中生成
晶格中生成![]() 。下列有关说法正确的是
。下列有关说法正确的是

A. 外电路电流方向:a→b
B. 电池正极反应式为:![]()
C. 可以用水代替电池中的混合有机溶剂
D. 用该电池给铅蓄电池充电,a极与Pb电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大型客机燃油用四乙基铅[Pb(CH2CH3)4])做抗震添加剂,但皮肤长期接触四乙基铅对身体健康有害,可用硫基乙胺(HSCH2CH2NH2)和KMnO4清除四乙基铅。
(1)锰元素在周期表中的位置是_____,基态锰原子的外围电子排布式为_____,该原子能量最高的电子的电子云轮廓图形状为____。
(2)N、C和Mn电负性由大到小的顺序为_____。
(3)HSCH2CH2NH2中C的杂化方式为____,其中NH2-空间构型为____;N和P的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是____。
(4)Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于_____晶体。已知Pb(CH2CH3)4晶体的堆积方式如下。

Pb(CH2CH3)4]在xy平面上的二维堆积中的配位数是______。设阿伏加德罗常数为NA/mol,Pb(CH2CH3)4]的摩尔质量为Mg/mol,则Pb(CH2CH3)4]晶体的密度是_____g/cm3 (列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com