
【题目】某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
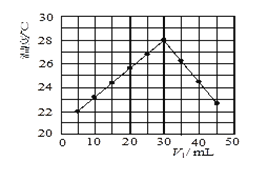
(1)研究小组做该实验时环境温度__________(填“高于”、“低于”或“等于”)22 ℃,判断的依据是____________
(2)由题干及图形可知,V1/V2=__________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为___________mol/L。
(3)若通过实验测定及有关计算知此反应共放出Q kJ的热量,请写出此反应的热化学方程式:____________
【答案】低于 从图形起点可知:5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,则溶液混合前的实验环境温度一定低于22℃ ![]() 1.5 HCl(aq)+NaOH(aq)= NaCl(aq) + H2 O(l) △H=
1.5 HCl(aq)+NaOH(aq)= NaCl(aq) + H2 O(l) △H=![]()
【解析】
(1).考虑中和反应是放热反应;
(2).当酸碱恰好反应时,放出的热量最高,从图示可知二者体积比,根据反应关系计算氢氧化钠的浓度;
(3)根据![]() 计算出△H,根据化学计量数和△H关系写出热化学方程式。
计算出△H,根据化学计量数和△H关系写出热化学方程式。
(1)从图形起点可知:5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,则溶液混合前的实验环境温度一定低于22 ℃;故答案为:低于;从图形起点可知:5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,则溶液混合前的实验环境温度一定低于22℃;
(2)当酸碱恰好反应时,放出的热量最高,从图示可知V1=30mL,V2=50mL-30mL=20mL,二者体积比为:![]() ,
,![]() ,故答案为:
,故答案为:![]() ;1.5;
;1.5;
(3)20mL1.5mol/L氢氧化钠与30mL1.0mol/L盐酸溶液进行中和反应生成水的物质的量为:0.02L ×1.50mol/L = 0.03mol ,△H=![]() ,故答案为:HCl(aq)+NaOH(aq)= NaCl(aq) + H2 O(l) △H=
,故答案为:HCl(aq)+NaOH(aq)= NaCl(aq) + H2 O(l) △H=![]() 。
。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
A.100g98%的浓H2SO4中所含的氧原子数为4NA(NA为阿伏加德罗常数,下同)
B.3.1g白磷晶体中含有的P﹣P键数是0.6NA
C.向Ca(HCO3)2溶液中加入Ca(OH)2溶液至过量:Ca2++2HCO3﹣+2OH﹣═CaCO3↓+CO![]() +2H2O
+2H2O
D.冰水中常会形成(H2O)x(x≥1)分子,原因是存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能LiFePO4电池多应用于公共交通,结构如图所示。电池中间是聚合物的隔膜,其主要作用是在反应过程中只让Li+通过,原理如下:(1x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。下列说法错误的是( )
LiFePO4+nC。下列说法错误的是( )

A.放电时,Li+向正极移动
B.放电时,电子由负极→用电器→正极
C.充电时,阴极反应为xLi++nC+xe-=LixCn
D.充电时,阳极质量增重
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠和铜的单质及其化合物在社会实际中有着广泛的应用。
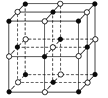
(1)NaCl晶体的晶胞结构如图所示,每个NaCl的晶胞中含有的阴离子的个数为__,阳离子周围最近且等距离得阴离子的个数为__。
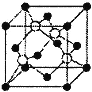
(2)碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀),A的晶胞如右图所示,则A的化学式是__,A中铜元素的化合价为__。
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过___键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是__。与NH3分子互为等电子体的一种阳离子是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到预期目的是( )
实验操作 | 实验目的 | |
A | 充满NO2的密闭玻璃球分别浸泡在冷、热水中 | 研究温度对化学平衡移动的影响 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 苯酚和水的浊液中,加少量浓碳酸钠溶液 | 比较苯酚与碳酸氢钠的酸性 |
D | 取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊 | 确定NaHCO3溶液中是否混有Na2CO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5min后达平衡状态,此时测得D的浓度为0.5mol/L,混合气体的总体积为134.4L(标准状况),C的平均反应速率为0.1mol/(L·min)。试求:
(1)此时C的浓度c(C)=__________mol/L,x的值为___________;
(2)反应开始前容器中的A.B的物质的量:n(A)=n(B)=________mol;
(3)A的平均反应速率为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国亚利桑那州大学和阿贡国家实验室的科学家最近设计出生产氢气的人造树叶,原理为2H2O(g) ![]() 2H2(g)+O2(g)。有关该反应的说法错误的是( )
2H2(g)+O2(g)。有关该反应的说法错误的是( )
A.没有人造树叶和太阳能的作用该反应不能自发进行
B.该反应最终是将太阳能转化为电能
C.该反应为充分利用太阳能开辟了广阔前景
D.氢能是理想的绿色能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下图所示的装置,模拟工业用含硫废水生产Na2S2O3·5H2O的过程。

锥形瓶C中发生反应:
①Na2S+H2O+SO2→Na2SO3+S
②2H2S+SO2→3S↓+2H2O
③S+Na2SO3![]() Na2S2O3
Na2S2O3
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若__________________,则整个装置气密性良好。装置D的作用是_________。装置E中为_________溶液。
(2)装置B可用于观察SO2的生成速率,其中的液体最好选择_________。
a.饱和食盐水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
锥形瓶C的溶液中含有Na2S和过量的Na2SO3.已知反应③的速率是三个反应中最慢的,则锥形瓶C中反应达到终点的现象是__________。
(3)反应结束后,锥形瓶C的溶液中除含Na2S2O3,还可能含Na2SO3、Na2SO4等杂质。用所给试剂设计实验,检测锥形瓶C的溶液中是否存在Na2SO4(供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)简要说明实验操作,现象和结论:_________________。
(4)实验前锥形瓶C溶液中含有0.08molNa2S和0.04molNa2SO3,反应结束后经一系列操作,得到纯净的Na2S2O3·5H2O晶体19.11g,则Na2S2O3·5H2O产率是_________(Na2S2O3·5H2O式量248)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。下列说法错误的是
ZnO(s)+2Ni(OH)2(s)。下列说法错误的是
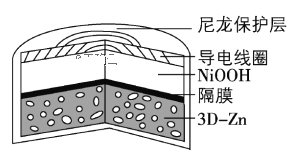
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.放电过程中OH通过隔膜从负极区移向正极区
C.充电时阴极反应为ZnO(s)+H2O(l) +2e= Zn(s)+2OH(aq)
D.放电时正极反应为NiOOH(s)+H2O(l) +e =Ni(OH)2(s)+OH(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com