
【题目】某溶液中可能存在Fe3+、Fe2+、I-、HCO![]() 、Cl-、NO
、Cl-、NO![]() 六种离子中的几种。进行下列实验:
六种离子中的几种。进行下列实验:
①取少量溶液滴加KSCN溶液,溶液呈红色;
②另取少量原溶液滴加盐酸,溶液的棕黄色加深。
据此可以推断,该溶液中一定大量存在的阴离子是( )
A. I- B. HCO![]() C. Cl- D. NO
C. Cl- D. NO![]()
科目:高中化学 来源: 题型:
【题目】中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图
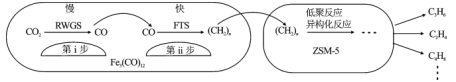
下列说法正确的是
A.第i步反应为CO2+H2=CO+H2O
B.第i步反应的活化能低于第ii步
C.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯的△H减小
D.添加不同助剂后,反应的平衡常数各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质,右图是元素周期表的一部分。
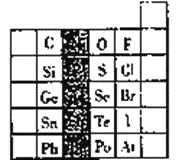
(1)阴影部分元素在元素周期表中的位置为第_________族。根据元素周期律、预测;酸性强弱H3AsO4______H3PO4(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度____________。(选填“更大”、“更小”或“相同”)
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是__________
(4)下列说法正确的是__________
A.C、N、O、F的原子半径随着原子数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1=+216.4kJ/mol
CO(g)+3H2(g) H1=+216.4kJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=–41.2kJ/mol
CO2(g)+H2(g) H2=–41.2kJ/mol
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)H=__。
CO2(g)+4H2(g)H=__。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是__(填序号)。
A.N2和H2的转化率相等
B.反应体系密度保持不变
C.![]() 保持不变
保持不变
D.![]() =2
=2
②P1__P2(填“>”“<”“=”或“不确定”,下同);反应的平衡常数:B点__D点。
③C点H2的转化率为__;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:v(A)___v(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。

(3)已知阴极室溶液呈酸性,则阴极的电极反应式为__。反应过程中通过质子交换膜(ab)的H+为2mol时,吸收柱中生成的气体在标准状况下的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺(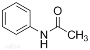 )在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(
)在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(![]() )和乙酸酐(
)和乙酸酐(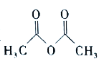 )反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为114℃,易溶于有机溶剂。在水中的溶解度如下。
)反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为114℃,易溶于有机溶剂。在水中的溶解度如下。
温度/℃ | 20 | 25 | 50 | 80 | 100 |
溶解度/(g/100g水) | 0.46 | 0.56 | 0.84 | 3.45 | 5.5 |
实验室制备乙酰苯胺的步骤如下(部分装置省略):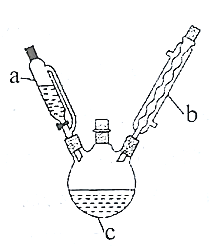
Ⅰ.粗乙酰苯胺的制备。将7mL(0.075mol)过量乙酸酐放入三颈烧瓶c中,在a中放入5mL(0.055mol)新制得的苯胺。将苯胺在室温下逐滴滴加到三颈烧瓶中。苯胺滴加完毕,在石棉网上用小火加热回流30min,使之充分反应。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有100mL冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用__洗涤晶体2-3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。
Ⅱ.乙酰苯胺的提纯。将上述制得的粗乙酰苯胺固体移入250mL烧杯中,加入100mL热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸5min,趁热过滤。待滤液冷却至室温,有晶体析出,__、洗涤、干燥后称量产品为5.40g。
回答下列问题:
(1)仪器b的名称是__。
(2)步骤I中,减压过滤的优点是过滤速度快,同时所得固体更干燥,用滤液而不用蒸馏水冲洗烧杯的原因是__;洗涤晶体最好选用__(填字母)。
A.乙醇 B.CCl4 C.冷水 D.乙醚
(3)步骤Ⅱ中,粗乙酰苯胺溶解后,补加少量蒸馏水的目的是__。
(4)步骤Ⅱ中,洗涤干燥前的操作是___。上述提纯乙酰苯胺的方法叫__。
(5)乙酰苯胺的产率为___。(计算结果保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的叙述正确的是

A.图1中,Zn—MnO2干电池放电时,MnO2被氧化
B.图2中,电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等
C.图3中,K分别与M、N连接,均可保护Fe电极,连接M时称为“牺牲阳极的阴极保护法”
D.图4中,在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl7-形式存在,则阳极反应式为:Al -3e-+7AlCl4-= 4Al2Cl7-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电絮凝的反应原理是以铝、铁等合金金属作为主电极,借助外加脉冲高电压作用产生电化学反应,把电能转化为化学能,以牺牲阳极金属电极产生金属阳离子絮凝剂,通过凝聚、浮除、还原和氧化分解将污染物从水体中分离,从而达到净化水体的目的。下列说法正确的是( )
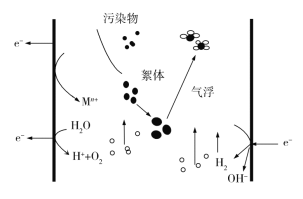
A.右极为阳极,左极为阴极
B.电子从左极经电解液流入右极
C.每产生1 mol O2,整个电解池中理论上转移电子数为4NA
D.若铁为阳极,则在处理废水过程中阳极附近会发生:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为672 mL的烧瓶中充满NO和NO2的混合气体,将其倒立在水槽里,去塞后再通入280 mL氧气,恰好完全反应,且液体充满烧瓶(气体体积都已折合为标准状况下的体积),下列有关叙述正确的是( )
A. 总反应为NO+NO2+O2+H2O===2HNO3
B. 总反应为4NO+8NO2+5O2+6H2O===12HNO3
C. 生成硝酸的物质的量浓度均为0.030 mol·L-1
D. 生成硝酸的物质的量浓度约为0.060 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种浓差电池的装置如图所示,碱液室中加入电石渣浆液[主要成分为![]() ],酸液室通入
],酸液室通入![]() (以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述正确的是 ( )
(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述正确的是 ( )
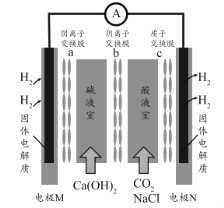
A. 电子由N极经外电路流向M极
B. N电极区的电极反应式为![]() ↑
↑
C. 在碱液室可以生成 ![]()
D. 放电一段时间后,酸液室溶液pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com