
【题目】如图是A、B、C三种固体物质的溶解度曲线。下列说法正确的是( )
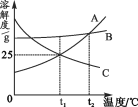
A. t1℃时,A的饱和溶液中溶质质量分数为25%
B. t2℃时,A、B、C三种物质的溶解度大小关系为A=B>C
C. 将t1℃时A、C的饱和溶液升温到t2℃时,A、C两溶液都会变成不饱和溶液
D. B中含有少量A,要提纯B可采用冷却热饱和溶液、趁热过滤的方法
科目:高中化学 来源: 题型:
【题目】下列各种仪器:①漏斗;②容量瓶;③温度计;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶。常用于物质分离的是( )
A.①③⑦B.②⑥⑦
C.①④⑧D.④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子的2p能级有3个电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。回答下列问题:
(1)写出基态E+的价电子排布式:_________。基态A原子的第一电离能比B的大,其原因是__________。
(2)A5+由美国空军研究实验室推进科学与先进概念部Karl .O. Christed 于1999年成功合成,其结构呈‘V'形且该离子中各原子均达到8电子稳定结构,则A5+的结构式为________。
(3)B3分子的空间构型为______,其中B原子的杂化类型是______,与B3分子互为等电子体的微粒有_________(写一种离子)。
(4)向E的硫酸盐溶液中通入A的气态氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。加入乙醇的目的___________。 写出该配合物中配离子的结构简式__________。
(5)由长周期元素组成的镧镍合金、铜钙合金有相同类型的晶体结构XYn,它们有很强的储氢能力,其中铜钙合金的晶体的部分结构如图所示。
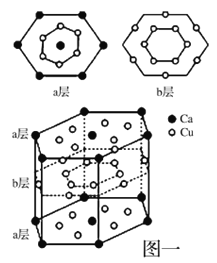
己知镧镍合金(LaNin)晶体中的重复结构单元如图一所示,该结构单元的体积为9.0×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶体空隙,体积不变),则LaNin中n=___ (填数值);氢在合金中的密度为_______g/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)是VIA族非金属元素,其单质和化合物在太阻能、电子、橡胶生产方面具有广泛的应用。
(1)根据碲(Te)在元素周期表中的位置,判断H2TeO4的酸性_____(填“大于”、“小于”或“无法判断”)H2SO4酸性。
(2)己知TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。TeO2和NaOH溶液发生反应的化学方程式为_________________。
(3)已知25℃时,亚碲酸(H2TeO3)的电离常数K1=1×10-3,K2=2×10-8。计算:
①0.1mol/L H2TeO3的电离度α约为_______(α=已电离弱电解质分子数/电解质分子总数×100%);
②NaHTeO3溶液的pH_____7(填“>”、“=”或“<”)。
(4)从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一和工芝流程如下:
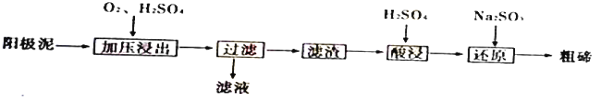
③己知加压酸浸时控制溶液的pH为5.0,生成TeO2沉淀。如果H2SO4溶液浓度过大,将导致TeO2沉淀不完全,原因是_____________。
④防止局部酸度过大的操作方法是___________。
⑤对滤渣“酸浸”后,将Na2SO3加入Te(SO4)2溶液中进行“还原”得到固态碲,该反应的离子方程式是____________。
⑥“还原”得到固态碲后分离出粗碲的方法是________,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一带路”为中国化工企业开辟了新的国际市场,能源环保是基础。在能源领域科学家提出构想——富集空气中的CO2,并使之与H2反应生成可再生能源甲醇.流程如下:
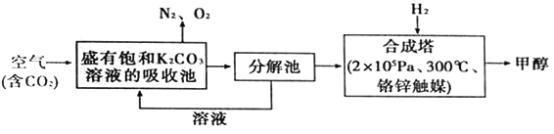
(1)在合成塔中,若有4400gCO2与足量H2完全反应,生成气态的H2O和气态甲醇,可放出5370kJ的热量,写出该反应的热化学方程式________________。
(2)一定条件下,向2L恒容密闭容器中充入1molCO2和3molH2在不同催化剂作用下发生反应I、反应II、反应III,相同时间内CO2的转化率随温度变化如图1所示:
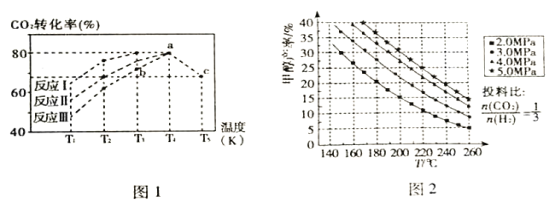
①催化效果最佳的反应是_________(填“反应I”、“反应II”、“反应III”)。
②b点反应速率v(正)______v(逆) (填“>”、“=”或“<”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________。
(3)选取合适的催化剂发生上述反应,测得甲醇的产率与反应温度、压强的关系如图2。
④分析图中数据可知,在220℃、5.0MPa时,CO2的转化率为________;将温度降低至140℃、压强减小至2.0MPa,CO2的转化率将_______(填“增大”、“减小”或“不变”)。
⑤200℃、2.0MPa时,将amol/LCO2和3amol/LH2充入VL密闭容器中,在催化剂作用下反应达到平衡。根据图中数据计算所得甲醇的质量______g(用含a、V的代数式表示)。
(4)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废旧电池中的铅膏(主要成分PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,PbSO4(s)+CO32-(aq)==PbCO3(s)+SO42-(aq),则该反应的平衡常数K=___(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将_____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理的发展在化学的发展史上有重要的推动作用。
(1)下图为N2和O2生成NO时的能量变化情况。

则NO分解为N2和O2的反应是 (填“吸热”或“放热”)反应。
(2)在某体积为2L的密闭容器中充入0.5molNO2和1molCO,一定条件下发生反应:
NO2(g)+ CO(g) ![]() CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.2mol。
CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.2mol。
①该段时间内,用CO2表示的平均反应率为 。
②下列事实能说明此反应在该条件下已经达到化学平衡的是 (填序号)。
A.容器内气体总质量保持不变 B.NO2的物质的量浓度不再改变
C.NO2的消耗速率与CO2的消耗速率相等 D.容器内气体总物质的量保持不变
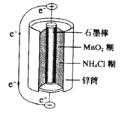
(3)锌锰干电池是最早使用的化学电池,其基本构造如下图所示。电路中每通过0.4mol电子,负极质量减少 g;工作时NH4+在正极放电产生两种气体,其中一种气体分子是含10电子的微粒,正极的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶上的标签的有关内容。试根据标签上的有关数据回答下列问题:
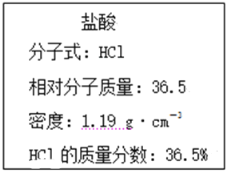
(1)该浓盐酸中HCl的物质的量浓度为_______________。
(2)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400 mol·L-1的稀盐酸,需要量取上述___________mL浓盐酸进行配制。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.2 g Cu投入100 mL稀硫酸中加热,没有明显变化,若边加热边缓缓加入一定量H2O2,金属Cu逐渐溶解,则下列说法正确的是( )
A. 反应过程中有刺激性气味的气体生成
B. H2O2对Cu和稀硫酸的反应起催化作用
C. 若Cu和硫酸恰好完全反应,则稀硫酸的物质的量浓度为0.5 mol·L-1
D. 反应中硫酸既表现出酸性又表现出氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后再滴加0.1 mol·L-1的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是( )
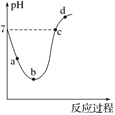
A. a点所示的溶液中c(H+)=c(Cl-)+c(HClO)+c(OH-)
B. b点所示的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-)
C. c点所示的溶液中c(Na+)=c(HClO)+c(ClO-)
D. d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com