
����Ŀ��ʵ������ȡ��Ȳ����������������H2S���������������ʵ����ȷ֤������������к�����Ȳ��H2S��
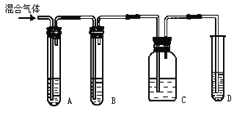
��1����ͼ��ʾA��B��C��Dװ���п�ʢ�ŵ��Լ���(�����)
A��________�� B��________�� C��________�� D��______��
��CuSO4��Һ ��NaOH��Һ ����ˮ ��KMnO4������Һ
��2����˵��H2S������ڵ�������___ _____��
��3��ʹ��װ��B��Ŀ����______ _��
��4��ʹ��װ��C��Ŀ����___ ��
��5��ȷ֤������Ȳ��������___ ��
���𰸡���1���٣��ڣ��٣���(���)
��2��װ��A���к�ɫ����
��3����ȥH2S���壬���������Ȳ������ʵ��
��4������H2S�Ƿ����
��5��װ��C��û�к�ɫ������װ��D�е���Һ��ɫ
��������
�����������Ȳ��H2S����ʹ��ˮ��ɫ��Ҳ����ʹ���Ը��������Һ��ɫ�������ڼ�����ȲǰҪ�ȼ���H2S�������ȥ��H2S��CuSO4��Һ��Ӧ���ɺ�ɫ��ͭ������CuSO4��Һ������H2S�����Ĵ��ڡ�H2S�����ܺͼ����Ӧ�����κ�ˮ��������������Һ��ȥH2S������H2S�����Ƿ���ɾ�����CuSO4��Һ���顣��������Ը��������Һ����ˮ����֤��Ȳ�Ĵ��ڣ�
��1����ͼ��ʾA��B��C��Dװ���п�ʢ�ŵ��Լ���(�����)
A���٣� B���ڣ� C���٣� D����(���)��
��2����˵��H2S������ڵ�������װ��A���к�ɫ������
��3��ʹ��װ��B��Ŀ���dz�ȥH2S���壬���������Ȳ������ʵ�飬
��4��ʹ��װ��C��Ŀ���Ǽ���H2S�Ƿ������
��5��ȷ֤������Ȳ��������װ��C��û�к�ɫ������װ��D�е���Һ��ɫ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ���������������X��Y��Z��G��Q��R��T����Ԫ�أ��˵������С��36����֪X��Y��Z��Ԫ�صĻ�̬ԭ��2p�ܼ����е����ӣ������Ӹ����ֱ���2��3��2��G��Tԭ���������18��TԪ�������ڱ���ds���ĵ�һ��Ԫ�أ�Qԭ��s�ܼ���p�ܼ���������ȣ�R������������ּ���������Ӳ�Ʒ�ĺ��IJ��ϡ�
��1��Yԭ�Ӻ����________�ֲ�ͬ�˶�״̬�ĵ��ӣ�TԪ�ػ�̬ԭ����________�ֲ�ͬ�ܼ��ĵ��ӡ�________����״��ͬ��ԭ�ӹ����
��2��X��Y��Z�ĵ縺���ɴ�С��˳��Ϊ________��G��Q��R��һ��������С�����˳��Ϊ________(��Ԫ�ط��ű�ʾ)��
��3��YԪ�ػ�̬ԭ�ӵĵ����Ų�ͼ________��TԪ�ػ�̬ԭ�ӵļ۵����Ų�ʽ________��
��4��XZ2�ĵ���ʽΪ________���õ��뷽��ʽ��ʾY������⻯���ˮ��Һ�ʼ��Ե�ԭ��________��
��5��+1����̬��������ʧȥһ�������γ�+2����̬��̬����������Ҫ��������Ϊ�ڶ�������I2�����λ���I3��I4��I5���������Ʋ�GԪ�صĵ�����ͻ��Ӧ�����ڵ�________�����ܡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����HI(g)�����ܱ������У�ij�¶��·������б仯��2HI(g) ![]() H2(g)+I2(g)��H��0
H2(g)+I2(g)��H��0
��1���÷�Ӧƽ�ⳣ���ı���ʽΪK=______________����H2(g)+I2(g) ![]() 2HI(g)ƽ�ⳣ���ı���ʽΪK1=_____________(��K��ʾ)��
2HI(g)ƽ�ⳣ���ı���ʽΪK1=_____________(��K��ʾ)��
��2������Ӧ�ﵽƽ��ʱc(I2)=0.5mol/L��c(HI)=4mol/L����c(H2)Ϊ________��HI�ķֽ���Ϊ________��
��3�����жϸ÷�Ӧ�ﵽƽ��״̬��������________
A��������ѹǿ����
B�����������c(HI)����
C��c(I2)=c(H2)
D��v(HI)��=v(H2)��
��4�����÷�Ӧ800��ʱ�ﵽƽ��״̬����ƽ�ⳣ��Ϊ1.0��ijʱ�̣���������ڸ����ʵ�Ũ���ֱ�Ϊc(HI)=2.0mol/L��c(I2)=1.0mol/L��c(H2)=1.0mol/L�����ʱ�̣���Ӧ��_________(������������������������ͬ)���У��������¶ȣ���Ӧ��_________���С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��5���л���ѧ�������ҹ��ɹ����Ƴ�����̪����־���ҹ�����Ѫ�ܼ�������ҩ���о�����ﵽ�˹����Ƚ�ˮƽ���ϳɶ���̪(J)��һ��·������
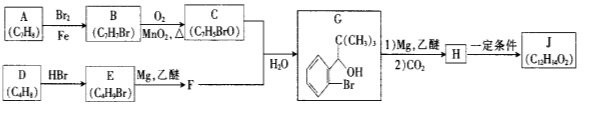
��֪:��

��E�ĺ˴Ź�������ֻ��һ��壻
��J��һ�����������г����������һ����Ԫ����
�ش��������⣺
��1����E��ϵͳ����
��2����B����C��Ӧ����Ϊ
��3��C�й���������Ϊ ��C����������� ��ԭ�ӹ�ƽ�档����֪��ȩ������ԭ�ӹ��棩
��4����H����J�Ļ�ѧ����ʽΪ ��д����Ӧ��������
��5��![]() ��CO2��Ӧ����X��X��ͬ���칹���У�
��CO2��Ӧ����X��X��ͬ���칹���У�
���ܷ���ˮ�ⷴӦ�����ܷ���������Ӧ���������Ȼ�����Һ������ɫ��Ӧ��
������������X��ͬ���칹�干�� �֣������dz�����ѧ��Χ��˳���칹�������칹����д���˴Ź�������ͼ����������շ��ͬ���칹��Ľṹ��ʽ ��
��6���ο�������Ϣ����ѧ֪ʶ��д���ɼ�ȩ�ͻ�����A�ϳ�2һ�����Ҵ���![]() ����·������ͼ�������Լ���ѡ�����ϳ�·������ͼ���﷽�������£�
����·������ͼ�������Լ���ѡ�����ϳ�·������ͼ���﷽�������£�
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��ͬѧ��Ƶ���ȡ������C2H4���ʵ�ʵ��װ��ͼ����ش��й����⣺
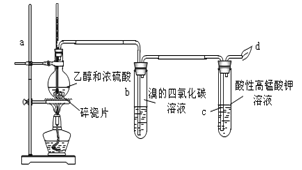
��1��д����������ϩ�ķ�Ӧ�Ļ�ѧ����ʽ�� ��
��2�����뼸Ƭ���Ƭ��Ŀ���� ��
��3������ʱ��ʹ���Һ�¶�Ѹ�����ߵ�170�棬��Ϊ�� ��
��4��ʵ����̹۲쵽������Ϊ��
��Br2�����Ȼ�̼��Һ�� ɫ�� ��
������KMnO4��Һ ��
��5����ͬѧ��Ϊ��ͬѧ��Ƶ�ʵ�������������KMnO4��Һ��ɫ����֤����Ӧ����ϩ���ɣ���Ϊ��Ӧ��������ϩ�п��ܻ��� ����Ҳ��ʹ����KMnO4��Һ��ɫ��д��������ʹ����KMnO4��Һ��ɫ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�������һ��ʵ����̽��Ԫ�������ɡ�
����ͬѧ�� �������ͼ1װ����һ���������֤�ǽ�����S>C>Si��ʵ���о���
����ͬѧ�� �������ͼ2װ������֤±��Ԫ�����ʵĵݱ���ɡ�
A��B�����ֱ��ǽ���NaBr��Һ������ʪ��ĵ���KI��ֽ��

��1������ͬѧ���ʵ��������� ��
�� A��Һ�������� ��
�� �ձ���C������Ӧ�����ӷ���ʽΪ ��
��2����ͬѧ��ʵ��ԭ����ͨ���۲첣�����е�ʵ��������֤±��Ԫ�����ʵĵݱ䡣
�� д��A��������Ӧ�����ӷ���ʽ ��
�� B����ʵ������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������-66������-66��������������������������˿���֯�������������·�����ϳɡ�D�ĺ˴Ź��������������塣
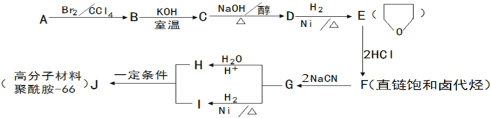
��֪��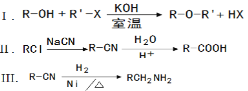
��1��1molA��1molH2��һ��������ǡ�÷�Ӧ�����ɱ���һԪ��X��X��̼Ԫ�ص���������ԼΪ65%����X�ķ���ʽΪ ��A���������������ŵ������� ��
��2��B��C�ķ�Ӧ������_________________��
��3��C��D�Ļ�ѧ����ʽΪ_______________________________________��
��4��F���������Ƶ��Ҵ���Һ���ȣ��õ��л�����Y
��Y��������_____________________��
��Y��һ�������¿��Է����Ӿ۷�Ӧ�õ���˳ʽ�ṹΪ����˳ʽ�ۺ����˳ʽ�ۺ���Ľṹ��ʽΪ_____________________________��
��5��H��I��Ӧ����J��������-66���Ļ�ѧ��Ӧ����ʽΪ_________________________��
Ϊ����F�еĹ����ţ������Լ�����NaOHˮ��Һ�� ��
��6��ͬʱ��������������H��ͬ���칹���ж��֡�д������һ��ͬ���칹��Ľṹ��ʽ(�˴Ź��������������壬�����Ϊ4:4:2)________________________��
��ֻ��һ�ֹ����� ��1mol������������������Һ��Ӧ������4molAg
��7����֪�� ![]()
![]()
д���Ա��Ӻ�HCHOΪԭ���Ʊ�![]() �ĺϳ�·������ͼ(���Լ�����)���ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ(���Լ�����)���ϳ�·������ͼʾ�����£�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⡿��֪��
![]()
![]() ��C��CH+��
��C��CH+��![]() ��H
��H![]() ��C��C��
��C��C��![]()
��CHO+![]()
![]() ��
��![]()
![]()
����ȲΪԭ�ϣ�ͨ����ͼ��ʾ�����ܺϳ��л��м���E��ת�������еķ�Ӧ���������ֲ�������ȥ����
![]()
![]() C2H2
C2H2![]() A
A![]() B
B![]() C
C![]() D
D![]() E��H��
E��H��![]()
![]()
![]() ��H
��H
������A��B��C��D�ֱ����һ���л�����B�Ļ�ѧʽΪC4H10O2������������
��ش��������⣺
��1��A����B�Ļ�ѧ��Ӧ������_________________��
��2��д������A�Ļ�ѧ��Ӧ����ʽ_________________________________________��
��3��B��Ũ������¼��ȣ������ɶ����л����д��2����Է���������AС���л�����Ľṹ��ʽ:_________________��__________________��
��4��д��C����D�Ļ�ѧ��Ӧ����ʽ��______________________________��
��5�����б���������E��Ϊͬ���칹�������___�֣�д������һ��ͬ���칹��Ľṹ��ʽ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ��pH�������ͬ������ʹ���������Һ�����������������
A��������NaOH��ȫ�к�ʱ��������Һ�����ĵ�NaOH��
B�����Ƿֱ�������CaCO3��Ӧʱ���ų���CO2һ����
C��������Һ��n(Cl��)= n(CH3COO��)��ͬ
D���ֱ���ˮϡ����ͬ����ʱ��n(Cl��)��n(CH3COO��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com