
【题目】某研究性学习小组用浓度为0.20mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。

(1)准确量取一定体积的待测液需要使用的仪器是______________。
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为________mL。
(3)滴定时,若以酚酞为指示剂,滴定达到终点的标志是______________________________。
(4)将准确称取的5.0g烧碱样品配制成250mL待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如下表所示。
滴定次数 | 待测液体积(mL) | 0.20mol·L-1的盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.70 | 20. 60 |
第一次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.10 | 21.10 |
由实验数据可知,烧碱的纯度为__________。
(5)下列操作会导致测得的待测液的浓度偏大的是________(填字母)。
a.部分标准液滴出锥形瓶外 b.用待测溶液润洗锥形瓶
C.锥形瓶洗净后还留有蒸馏水 d.放出碱液的滴定管开始有气泡,放出液体后气泡消失
【答案】 碱式滴定管(或移液管) 26.10 滴入最后一滴标准液,溶液由红色变为无色,且半分钟内不恢复红色 80% ab
【解析】本题考查滴定实验,(1)因为是准确量取一定体积的待测液,因此应用滴定管或移液管,滴定管和移液管的精确度是0.01mL,样品是烧碱,使用滴定管时,应选择碱式滴定管;(2)根据图,开始时刻度为0,滴定终点后刻度为26.10mL,因此消耗盐酸标准液体积为26.10mL;(3)说明滴定达到终点:滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不恢复红色;(4)三次消耗的盐酸的体积分别为19.9、20.10、20.00,三次平均消耗盐酸的体积为(19.9+20.10+20.00)/3mL=20.00mL,盐酸与氢氧化钠发生NaOH+HCl=NaCl+H2O,n(NaOH)=n(HCl)=20.00×10-3×0.2mol=4×10-4mol,250mL溶液中n(NaOH)=4×10-4×250/10mol=0.1mol,其质量为0.1×40g=4g,则纯度为4/5.0×100%=80%;(5)根据c(NaOH)=c(HCl)×V(HCl)/V(NaOH),a、部分标准液滴出锥形瓶,造成消耗V(HCl)增大,即所测氢氧化钠的浓度偏大,故a正确;b、用待测液润洗锥形瓶,造成锥形瓶中溶质物质的量增大,即消耗V(HCl)增大,即所测浓度偏高,故b正确;c、锥形瓶中是否有水,对实验无影响,故c错误;d、放出碱液的滴定管开始有气泡,放出液体后气泡消失,造成锥形瓶中待测液的体积减小,消耗盐酸体积减小,即所测溶液的浓度偏小,故d错误。


科目:高中化学 来源: 题型:
【题目】阿塞那平用于治疗精神分裂症,可通过以下方法合成(部分反应条件略去):
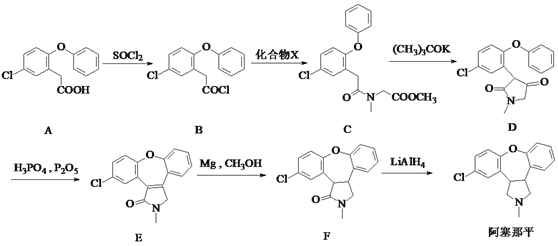
(1)阿塞那平中的含氧官能团为______________(填官能团的名称)。由F→阿塞那平的反应类型为____________。
(2)化合物X的分子式为C4H9NO2,则由B→C反应的另一产物的化学式___________。
(3)由D生成E的过程中先后发生加成反应和消去反应,则加成反应后中间体的结构简式为 ________。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:___________。
Ⅰ.属于芳香化合物,分子中含有酯基且只有5种不同化学环境的氢;
Ⅱ.能发生银镜反应和水解反应,水解产物能与FeCl3溶液发生显色反应。
(5)已知:![]() ,卤代烃碱性条件下不与醇反应。请写出以CH3Cl、 CH3NH2和
,卤代烃碱性条件下不与醇反应。请写出以CH3Cl、 CH3NH2和![]() 为原料制备
为原料制备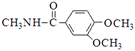 的合成路线流程图(无机试剂任用)。合成路线流程图示例如:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如:![]() _________________
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料的性质在很大程度上决定了它们的用途。下列相关说法不正确的是( )
A. 钛合金具有强度高、耐热性好等特点,主要用来制作飞机发动机部件
B. 铁具有良好的导热性,可以用于制造炊具
C. 不锈钢抗腐蚀性好,常用于制造医疗器械
D. 铅锑合金的熔点较低,常用于制造发热体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1) 为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2) (设为装置A) 称重,记为m1g。将样品装入石英玻璃管中,再次将装置A 称重,记为m2g。按下图连接好装置进行实验。

①将下列实验操作步骤正确排序________(填标号) ;重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
②根据实验记录,计算绿矾化学式中结晶水数目x=_______(列式表示)。若实验时按a、d 次序操作,则使x_____(填“偏大”“偏小”或“无影响”)。
(2) 为探究硫酸亚铁的分解产物,将(1) 中已恒重的装置A 接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D 中的溶液依次为________(填标号)。C、D中有气泡冒出,并观察到的现象分别是_____。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能与盐酸反应,又能与NaOH溶液反应的是( )
①NaHCO3②(NH4)2S③Al(OH)3④NH4Cl⑤H2N-CH2-COOH ⑥CH3COOH
A. ①②③ B. ①②④⑤ C. ⑤⑥ D. ①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类、油脂、蛋白质的说法正确的是
A. 糖类物质一定能发生水解反应
B. 油脂可用于制造肥皂等
C. 糖类、油脂、蛋白质的组成元素均为C、H、O
D. 蛋白质遇饱和硫酸钠溶液会凝聚,失去生理功能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+ H2O = 2H++ Cl-+ ClO-
B.氧化亚铁溶于稀硝酸:FeO + 2H+=Fe2++ H2O
C.向三氯化铝溶液中滴入过量氨水:Al3++3NH3·H2O =Al(OH)3↓+3NH4+
D.金属钠投入水中:Na + 2H2O =Na++ 2OH-+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是( )
A. 2SO2 + O2![]() 2SO3 △H= -196.6kJ/mol
2SO3 △H= -196.6kJ/mol
B. N2(g)+2O2(g)=2NO2(g) △H= +67.7kJ/mol
C. C(s)+O2(g)=CO2(g) △H= +393.5kJ/mol
D. H2O(l)==H2(g)↑+1/2O2(g)↑ △H= +285.8kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com