
����Ŀ����֪:25��,NH3��H2O����ƽ�ⳣ��K��1.76��10��5��25��,��1 L 0.1 mol/LijһԪ��HR��Һ����ͨ�백��������Һ�¶Ⱥ�������ֲ��䣬���û����Һ��pH��![]() �仯�Ĺ�ϵ��ͼ��ʾ������������ȷ����
�仯�Ĺ�ϵ��ͼ��ʾ������������ȷ����

A. ��ͼ����֪��25��,0.1 mol/L NaR��Һ��pHԼΪ10
B. ��ͨ��0.1 mol NH3ʱ��������Һ�У�c(NH4+)��c(R��)��c(OH��)��c(H+)
C. pH��7ʱ��������Һ�У�c(HR)��c(R��) =c(NH4+)
D. pH��10ʱ��������Һ�У�c(R��)��c(HR) ��c(NH4+)��c(NH3��H2O)
���𰸡�B
��������A. ��ͼ��֪��pH=5ʱ��![]() ������
������![]() �����ԣ�25��,0.1 mol/L NaR��Һ����
�����ԣ�25��,0.1 mol/L NaR��Һ����![]() ��
��![]() ������pHԼΪ9��A����ȷ��B. ��ͨ��0.1 mol NH3ʱ��������Һ�е�����ΪNH4R��NH4R�����������ӿ��Է�������˫ˮ�⣬����NH3��H2O����ƽ�ⳣ��K��1.76��10��5����HR��
������pHԼΪ9��A����ȷ��B. ��ͨ��0.1 mol NH3ʱ��������Һ�е�����ΪNH4R��NH4R�����������ӿ��Է�������˫ˮ�⣬����NH3��H2O����ƽ�ⳣ��K��1.76��10��5����HR��![]() ���� R����ˮ��̶Ƚϴ���Һ�Լ��ԣ�����c(NH4+)��c(R��)��c(OH��)��c(H+)��B��ȷ��C. pH��7ʱ����ͼ��֪��
���� R����ˮ��̶Ƚϴ���Һ�Լ��ԣ�����c(NH4+)��c(R��)��c(OH��)��c(H+)��B��ȷ��C. pH��7ʱ����ͼ��֪��![]() ����
����![]() ������c(R��)��c(HR)���ɵ���غ��֪c(R��) =c(NH4+)�����ԣ�������Һ��c(R��) =c(NH4+)��c(HR) ��C����ȷ��D. pH��10ʱ��c(OH��)=
������c(R��)��c(HR)���ɵ���غ��֪c(R��) =c(NH4+)�����ԣ�������Һ��c(R��) =c(NH4+)��c(HR) ��C����ȷ��D. pH��10ʱ��c(OH��)=![]() ����NH3��H2O����ƽ�ⳣ��K��1.76��10��5���������
����NH3��H2O����ƽ�ⳣ��K��1.76��10��5���������![]() ������c(NH4+)��c(NH3��H2O)����ͼ��֪��pH��10ʱ��
������c(NH4+)��c(NH3��H2O)����ͼ��֪��pH��10ʱ��![]() ����
����![]() ������c(R��)��c(HR) �� D����ȷ������ѡB��
������c(R��)��c(HR) �� D����ȷ������ѡB��


 ����ѧ����ϵ�д�
����ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�е������仯���ɻ�ѧ��Ӧ�оɻ�ѧ������ʱ���յ������뻯ѧ���γ�ʱ�ų���������ͬ����ġ���ͼΪN2(g)��O2(g)��Ӧ����NO(g)�����е������仯������˵������ȷ����

A. 1molN2(g)��1molO2(g)��Ӧ�ų�������Ϊ180kJ
B. 1molN2(g)��1molO2(g)�����������2molNO(g)���������
C. ��1L�������з�����Ӧ��10min��N2������1mol�����10min�ڵ�ƽ����Ӧ����Ϊv(NO)=0��1mol/(L��min)
D. NO��һ���������������NaOH��Һ��Ӧ�����κ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2A��g��+3B��g��4C��g��+D��g������֪��ʼŨ��c��A��=4molmol��1 �� c��B��=3molmol��1 �� C��DŨ�Ⱦ�����0����Ӧ��ʼ2���ﵽƽ��״̬����ʱD��ƽ��Ũ��Ϊ0.5molL��1 �� ������˵������ȷ���ǣ�������
A.��Ӧ����v��C��=1molL��1s��1
B.C��ƽ��Ũ��Ϊ4 molL��1
C.A��ת����Ϊ25%
D.B��ƽ��Ũ��Ϊ1.5 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ�ɷ�ΪFeS2��Ϊԭ���Ʊ��Ȼ������壨FeCl3��6H2O���Ĺ����������£�

���������գ�
��1�����ղ�����SO2���Լ����Ʊ����ᣬ���еķ�Ӧ֮һΪ��2SO2+O2 ![]() 2SO3+Q(Q>0)���÷�Ӧ��ƽ�ⳣ������ʽΪK=___________����ʹKֵ���ɲ�ȡ�Ĵ�ʩ��______________������һ��ʱ���SO3��Ũ��������4mol/L�������ʱ������O2��ʾ�ķ�Ӧ����Ϊ0.4 mol/(Ls)�������ʱ��Ϊ_______��ѡ���ţ���
2SO3+Q(Q>0)���÷�Ӧ��ƽ�ⳣ������ʽΪK=___________����ʹKֵ���ɲ�ȡ�Ĵ�ʩ��______________������һ��ʱ���SO3��Ũ��������4mol/L�������ʱ������O2��ʾ�ķ�Ӧ����Ϊ0.4 mol/(Ls)�������ʱ��Ϊ_______��ѡ���ţ���
a��1s b��5s c��10s d��50s
��2���������պ�������к���Fe2O3��Fe3O4�ȡ����ܺ���Һ����Ҫ���ڵ���������______________��������������������ԭ����____________________________��
��3��ͨ������ʱ����Ҫ��Ӧ�����ӷ���ʽΪ________________________�������������Һ�еõ��Ȼ��������ʵ�鲽��Ϊ_______________��_______________������ϴ�ӡ�
��4�����ܼ����������о��豣��������������ˮ��ƽ���ƶ�ԭ������ԭ��_________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���X��Y��Z�ķ���ʽ��ΪC7H8���ṹ��ʽ���£�
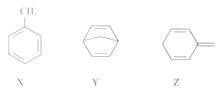
����˵����ȷ����
A. X��Y��Z��Ϊ����ͬϵ��
B. X��Y��Z�����е�̼ԭ�Ӿ�����ͬһƽ��
C. X��Y��Z����ʹ���Ը��������Һ��ɫ
D. 1molX��1molY�ֱ�������������Ȼ�̼��Һ��Ӧ�����������2mol Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��Ҫ���Ȳ��ܷ����Ļ�ѧ��Ӧ�������ȷ�Ӧ
B. Ӧ�ø�˹���ɿ��Լ���ijЩ���Բ����ķ�Ӧ�ʱ�
C. �κ���ʹ��ֵ����Ĺ��̶����Է�����
D. ��ѧƽ�ⷢ���ƶ���ƽ�ⳣ��һ�������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯�ؿ������л��ϳɡ���ҩ����������һ�ְ�ɫ�����ᾧ���ĩ��������ˮ��������ѧϰС��������Ϻֱ��������ʵ��װ���Ʊ�KI��
���������ϡ���
��1��3I2+6KOH�TKIO3+5KI+3H2O
��2��H2S���о綾���������壬���н�ǿ��ԭ�ԣ�ˮ��Һ�������ᣨ���ᣩ��
��3��HCOOH�����ᣩ����ǿ�Ҵ̼�����ζ��Һ�壬���н�ǿ��ԭ�ԣ����
��4����ʵ�������£�S2-��HCOOH�ֱ�KIO3����ΪSO42-��CO2��
����. H2S��ԭ����ʵ��װ����ͼ��

ʵ�鲽�����£�
������ͼ��ʾ��C�м���127g��ϸ�ĵ���I2��210g 30%��KOH ��Һ������������ȫ�ܽ⡣
�ڴ��ɼ�������ͨ�������� H2S��
�۽�װ��C��������Һ��ϡH2SO4�ữ������ˮԡ�ϼ���10min��
����װ��C����Һ�м���BaCO3����ֽ�����ˡ�ϴ�ӡ�
�ݽ���Һ��������ữ����������Һ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����ò�Ʒ145g��
����.���ỹԭ����ʵ��װ����ͼ��

ʵ�鲽�����£�
��������ƿ�м��� 127g ��ϸ�ĵ���I2��210g 30%�� KOH ��Һ������������ȫ�ܽ⡣
��ͨ����Һ©����Ӧ�����Һ�еμ�������HCOOH����ַ�Ӧ������KOH��Һ��pH��9~10����������Һ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����ò�Ʒ 155g��
�ش��������⣻
��1��ͼ��װ�� A �з�����Ӧ�����ӷ���ʽΪ__________��װ�� B �е��Լ���_________��
��2��Dװ�õ�������___________��
��3������ܵ�Ŀ����_____________________ ��
��4��������С���Һ��������ữ����Ŀ����__________________ ��
��5������ʵ��IJ���Ϊ__________________��
��6������ʵ���У�����HCOOH����������ԭ��Ӧ�����ӷ���ʽΪ_______________��
��7���������Ƚϣ�����ʵ����ŵ��ǣ����ٴ�����㼴�ɣ�__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1��д���������е����Ų����������ڱ��е�λ�ã�
��A����1s22s22p63s23p6 �� �����ڵ��壮
��Bԭ�ӡ�2s22p3 �� �����ڵ��壮
��2����Χ�����Ų�ʽΪ3d54s2��ԭ�ӣ���ԭ�ӽṹʾ��ͼΪ �� ���������Ϊ���ǵ������壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ݸ�Ŀ�������վ�����Ŀ��д��������Ԫʱʼ���䷨����Ũ�ƺ�����굣�����������������ˮ��ζ��Ũ�ң��Ǿ�¶Ҳ�����������õ���������ָ��������
A.��ȡB.����C.����D.����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com