
【题目】某烃A是有机化学工业的基本原料,还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:

(1)写出A、B、C、D的结构简式:A___,B___,C__,D__。
(2)写出②④两步反应的化学方程式,并注明反应类型:
②___,反应类型:___。
④___,反应类型:___。
【答案】CH2=CH2 CH3CH3 CH3CH2Cl CH3CH2OH CH2=CH2+HCl![]() CH3CH2Cl 加成反应 CH3CH3+Cl2
CH3CH2Cl 加成反应 CH3CH3+Cl2![]() CH3CH2Cl+HCl 取代反应
CH3CH2Cl+HCl 取代反应
【解析】
某烃A是有机化学工业的基本原料,还是一种植物生长调节剂,则A为乙烯,乙烯与H2发生加成生成乙烷,乙烯和HCl发生加成生成氯乙烷,乙烯和H2O发生加成生成乙醇,则A、B、C、D的结构简式分别是CH2=CH2、CH3CH3、CH3CH2Cl、CH3CH2OH。
(1)根据上述分析,A为乙烯,结构简式为CH2=CH2,B为乙烷,结构简式为CH3CH3,C为氯乙烷,结构简式为CH3CH2Cl,D为乙醇,结构简式为CH3CH2OH;
(2) ②为乙烯与HCl发生加成反应,化学方程式为CH2=CH2+HCl![]() CH3CH2Cl;
CH3CH2Cl;
④乙烷和Cl2在光照条件下发生取代反应,化学方程式为CH3CH3+Cl2![]() CH3CH2Cl+HCl。
CH3CH2Cl+HCl。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】市场上经常见到的标记为Li-ion的电池。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为: Li+2Li0.35NiO2![]() 2Li0.85NiO2,下列说法正确的是
2Li0.85NiO2,下列说法正确的是
A. 充电时,该电池的正极应外接电源负极
B. 充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C. 该电池既能用酸溶液又能用碱溶液作电解质溶液。
D. 放电过程中Li+向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
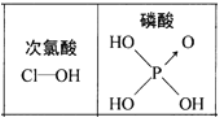
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.乳酸(![]() )存在对映异构体,因为其分子中含有一个手性碳原子
)存在对映异构体,因为其分子中含有一个手性碳原子
C.在NH3分子中存在极性共价键和配位键
D.由上图知酸性: ![]() ,因为
,因为![]() 分子中有非羟基氧原子
分子中有非羟基氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计了一种可以循环利用人体呼出的CO2并提供O2的装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( )
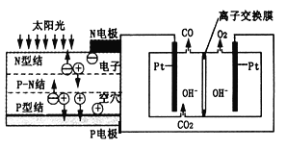
A. 由图分析N电极为电池的正极
B. 阴极的电极反应为CO2+H2O+2e-=CO+2OH-
C. OH-通过离子交换膜迁向左室
D. 反应完毕,该装置中电解质溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像的说法正确的是
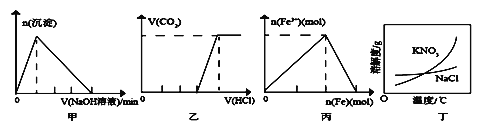
A. 图甲表示:向某明矾溶液中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与滴加NaOH溶液体积的关系
B. 图乙表示:向含等物质的量的NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸至过量,生成气体的体积与滴加HCl溶液体积的关系
C. 图丙表示:在稀硝酸溶液中逐渐加入铁粉至过量,溶液中Fe3+物质的量与逐渐加入铁粉物质的量的变化关系
D. 除去混在硝酸钾中少量的氯化钠可用“蒸发浓缩、趁热过滤”的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可燃冰(天然气水合物,可用CH4xH2O表示)的开采和利用,既有助于解决人类面临的能源危机,又能生产一系列的工业产品。
(1)可燃冰在一定条件下能够释放出CH4气体,该条件是________(填“低温、高压”或“高温、低压”)。
(2)熔融碳酸盐型燃料电池(MCFC)通常被称为第二代燃料电池。以CH4为MCFC的燃料时,电池的工作原理如图所示。
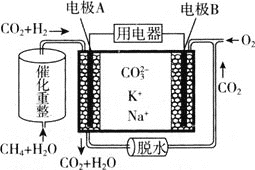
①CH4(g)和H2O(g)可在电池内部经重整反应转化为H2(g)和CO2(g),已知CH4和H2的标准燃烧热分别为890.3kJ/mol和285.8kJ/mol,H2O(l)=H2O(g) H=+41 kJ/mol,则甲烷重整反应的热化学方程式为CH4(g)+2H2O(g)=4H2(g)+CO2(g) H=________kJ/mol。
②图中电极A为燃料电池的________(填“正极”或“负极”),电极B上的电极反应式为________。
(3)在压强为p的恒压容器中,CH4在电弧炉的作用下制取乙炔,化学方程式为2CH4=C2H2+3H2。下表为反应体系的物料衡算表。
成分 | 进料 | 出料 | ||
纯CH4 | CH4 | C2H2 | H2 | |
物质的量(mol) | 44.8 | 19.13 | 8.96 | 39.5 |
①计算可知C2H2的产率α=________。
②出料中C2H2和H2的物质的量之比并不等于1:3,可能的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl=SiHCl3+H2
③SiHCl3与过量H2在1 100 ℃反应制得纯硅,已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_____。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为_____。
(3)用SiHCl3与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):

①装置B中的试剂是_____,装置C中的烧瓶需要加热,其目的是______。
②反应一段时间后,装置D中观察到的现象是____,装置D中发生反应的化学方程式为____。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及____。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是____(填写字母代号)。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )
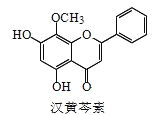
A.汉黄芩素的分子式为 C16H13O5
B.与足量 H2发生加成反应后,该分子中官能团的种类减少 1 种
C.1 mol 该物质与溴水反应,最多消耗 1mol Br2
D.该物质遇 FeCl3 溶液显色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.能使石蕊试液显蓝色的溶液:Na+、Al3+、NO![]() 、SO
、SO![]()
B.能使甲基橙显红色的溶液:Mg2+、K+、HCO![]() 、Cl-
、Cl-
C.c(NaCl)=0.1 mol·L-1的溶液:NH![]() 、Ca2+、NO
、Ca2+、NO![]() 、Br-
、Br-
D.KW/c(OH-)=0.1 mol·L-1的溶液:Na+、Fe2+、SO![]() 、NO
、NO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com