
【题目】市场上经常见到的标记为Li-ion的电池。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为: Li+2Li0.35NiO2![]() 2Li0.85NiO2,下列说法正确的是
2Li0.85NiO2,下列说法正确的是
A. 充电时,该电池的正极应外接电源负极
B. 充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C. 该电池既能用酸溶液又能用碱溶液作电解质溶液。
D. 放电过程中Li+向负极移动
【答案】B
【解析】
根据锂离子电池的电池反应式为:Li+2Li0.35NiO2![]() 2Li0.85NiO2,可知,放电时,Li的化合价升高,被氧化,Li为原电池的负极,负极的电极反应式:Li-e-=Li+;充电时,反应逆向进行,反应物只有一种,故化合价既有升,又有降,所以既发生氧化反应又发生还原反应,也可根据Li0.85NiO2的Ni的化合价升高后变为Li0.35NiO2,被氧化,部分Li+还原为Li,判断出充电时,Li0.85NiO2既发生氧化反应又发生还原反应;由于Li能与水反应,因此应为非水材料;原电池工作时,阳离子向正极移动,阴离子向负极移动。
2Li0.85NiO2,可知,放电时,Li的化合价升高,被氧化,Li为原电池的负极,负极的电极反应式:Li-e-=Li+;充电时,反应逆向进行,反应物只有一种,故化合价既有升,又有降,所以既发生氧化反应又发生还原反应,也可根据Li0.85NiO2的Ni的化合价升高后变为Li0.35NiO2,被氧化,部分Li+还原为Li,判断出充电时,Li0.85NiO2既发生氧化反应又发生还原反应;由于Li能与水反应,因此应为非水材料;原电池工作时,阳离子向正极移动,阴离子向负极移动。
A.充电时,该电池的正极应外接电源正极,作阳极,A错误;
B.充电时,Li0.85NiO2变为Li0.35NiO2和Li,Ni的化合价升高,被氧化,部分Li+被还原为Li,所以Li0.85NiO2既发生氧化反应又发生还原反应,B正确;
C.Li很活泼,会与水反应,不能用水溶液,C错误;
D.原电池中阳离子移向正极,则Li+向正极移动,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】亚硝酰氯![]() 是有机物合成中的重要试剂,其沸点为
是有机物合成中的重要试剂,其沸点为![]() ,易水解。已知:
,易水解。已知:![]() 微溶于水,能溶于硝酸,
微溶于水,能溶于硝酸,![]() ,某学习小组在实验室用
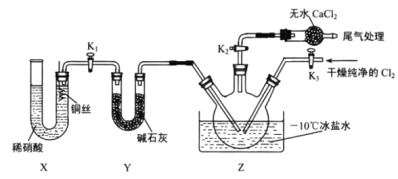
,某学习小组在实验室用![]() 和NO制备ClNO并测定其纯度,相关实验装置如图所示。
和NO制备ClNO并测定其纯度,相关实验装置如图所示。
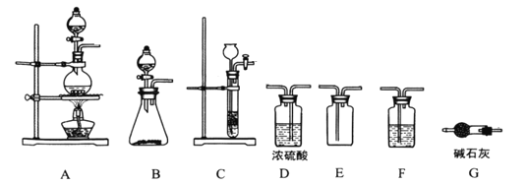
⑴制备![]() 的发生装置可以选用_______(填字母代号)装置,发生反应的离子方程式为___________。
的发生装置可以选用_______(填字母代号)装置,发生反应的离子方程式为___________。
⑵欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为![]() ________________(填字母代号)。
________________(填字母代号)。
⑶实验室可用图示装置制备亚硝酰氯,检验装置气密性并装入药品,打开![]() ,然后再打开
,然后再打开![]() ,通入一段时间气体,其目的是____________,然后进行其他操作,当Z中有一定量液体生成时,停止实验。
,通入一段时间气体,其目的是____________,然后进行其他操作,当Z中有一定量液体生成时,停止实验。
⑷已知:ClNO水解生成![]() 写出化学反应方程式__________________。
写出化学反应方程式__________________。
①欲设计实验证明![]() 是弱酸,需选择如下_____________试剂开展实验
是弱酸,需选择如下_____________试剂开展实验![]() 填选项
填选项![]() 。
。
A. ![]() 溶液 B.
溶液 B. ![]() 溶液 C. 红色石蕊试纸 D. 蓝色石蕊试纸
溶液 C. 红色石蕊试纸 D. 蓝色石蕊试纸
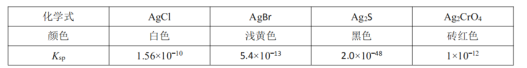
![]() 已知下列物质在常温下的
已知下列物质在常温下的![]() 如图:
如图:
通过以下实验测定ClNO样品的纯度。取Z中所得液体![]() 溶于水,配制成
溶于水,配制成![]() 溶液;取出
溶液;取出![]() 样品溶于锥形瓶中,用
样品溶于锥形瓶中,用![]() 标准溶液滴定至终点,应加入的指示剂是_______________。
标准溶液滴定至终点,应加入的指示剂是_______________。
A.![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
消耗标准溶液的体积为![]() ,滴定终点的现象是 ________________,亚硝酰氯
,滴定终点的现象是 ________________,亚硝酰氯![]() 的质量分数为________。
的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol有机化合物A与标准状况下5.6L氧气混合,一定条件下两者完全反应,只有CO、CO2和H2O三种产物,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重5.4克,碱石灰增重4.4克,还有标准状况下2.24L气体的剩余,求:
(1)有机化合物A的分子式_______(要求写出推理过程);
(2)若有机化合物A能与钠反应放出氢气,请写出A的结构简式_________;
(3)写出所有比A多一个—CH2—原子团的同系物的结构简式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用软锰矿(主要成分为MnO2,含有少量的SiO2和FeS2杂质)为原料制取高纯MnO2,其工艺流程如下:

回答下列问题:
(1)步骤①将软锰矿研磨成细粉的主要目的是________;步骤②酸浸取时,主要产物有S、MnSO4及Fe2(SO4)3,写出反应的化学方程式:________。
(2)滤渣Ⅰ的主要成分是________。
(3)步骤④加入氨水调节pH=4,过滤后的滤液中,c(Fe3+)=________mol/L。{已知Ksp[Fe(OH)3]=1×10-38}
(4)步骤⑤所得的滤渣Ⅱ可用于制备铁红,该反应的化学方程式为________。

(5)步骤⑥电解MnSO4酸性溶液,原理如图所示。阳极产生MnO2,其电极反应式为________;阴极产生的气体为________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
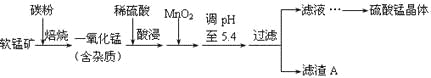
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是( )

A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6Kjmol﹣1
B.乙表示恒温恒容条件下发生的可逆反应2NO2![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列各组离子一定能大量共存的是( )
A.滴入石蕊试液显红色的溶液:K+、Mg2+、AlO2、SO32
B.1.0mol·L1的KNO3溶液:H+、Fe2+、Cl、SO42
C.在![]() =1×1012的溶液中:NH4+、Fe2+、Cl-、NO3
=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3
D.通入足量CO2的溶液:Ca2+、Cl、K+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
A. υ (C)=0.5 mol / L·s B. υ(D)=0.4 mol / L·s
C. υ(B)=0.6 mol / L·s D. υ(A)=0.15 mol / L·s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:

(1)写出A、B、C、D的结构简式:A___,B___,C__,D__。
(2)写出②④两步反应的化学方程式,并注明反应类型:
②___,反应类型:___。
④___,反应类型:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com