
【题目】工业上用软锰矿(主要成分为MnO2,含有少量的SiO2和FeS2杂质)为原料制取高纯MnO2,其工艺流程如下:

回答下列问题:
(1)步骤①将软锰矿研磨成细粉的主要目的是________;步骤②酸浸取时,主要产物有S、MnSO4及Fe2(SO4)3,写出反应的化学方程式:________。
(2)滤渣Ⅰ的主要成分是________。
(3)步骤④加入氨水调节pH=4,过滤后的滤液中,c(Fe3+)=________mol/L。{已知Ksp[Fe(OH)3]=1×10-38}
(4)步骤⑤所得的滤渣Ⅱ可用于制备铁红,该反应的化学方程式为________。

(5)步骤⑥电解MnSO4酸性溶液,原理如图所示。阳极产生MnO2,其电极反应式为________;阴极产生的气体为________(写化学式)。
【答案】增大接触面积,提高硫酸浸取时的浸取率及反应速率 3MnO2+2FeS2+6H2SO4=3MnSO4+Fe2(SO4)3+4S+6H2O S、SiO2 1×10-8 2Fe(OH)3![]() Fe2O3+3H2O Mn2++2H2O-2e-=MnO2+4H+ H2
Fe2O3+3H2O Mn2++2H2O-2e-=MnO2+4H+ H2
【解析】
(1)将软锰矿磨成细粉,可提高浸取率;MnO2和FeS2与硫酸反应生成S、MnSO4及Fe2(SO4)3;
(2)S、SiO2不与硫酸反应;
(3)根据Ksp[Fe(OH)3]计算;
(4)滤渣Ⅱ为Fe(OH)3,受热分解得到Fe2O3;
(5)阳极发生氧化反应,MnSO4失去电子产生MnO2;阴极由氢离子得电子生成氢气。
(1)为了提高浸取率,将软锰矿磨成细粉,主要目的是:增大接触面积,提高硫酸浸取时的浸取率及反应速率;MnO2和FeS2与硫酸反应生成S、MnSO4及Fe2(SO4)3,则化学方程式为3MnO2+2FeS2+6H2SO4=3MnSO4+Fe2(SO4)3+4S+6H2O;
(2)S、SiO2不与硫酸反应,最后以沉淀的形式分离出来;
(3)pH=4时,c(OH-)=10-10mol/L,c(Fe3+)=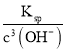 =
=![]() =1×10-8mol/L;
=1×10-8mol/L;
(4)步骤⑤所得的滤渣Ⅱ为Fe(OH)3,受热分解,得到Fe2O3,则化学方程式为:2Fe(OH)3Fe2O3+3H2O;
(5)阳极发生氧化反应,MnSO4失去电子产生MnO2,电极反应式为:Mn2++2H2O-2e-=MnO2+4H+;阴极由氢离子得电子生成氢气。


科目:高中化学 来源: 题型:
【题目】(1)“民以食为天,食以安为先”。近年来屡屡发生的 劣质奶粉、苏丹红、多宝鱼等食品安全事件严重威胁消费者的健康和生命安全。下列有关蛋白质的说法正确的是____________(填序号)。
A.蛋内质是重要的营养物质,也是提供人体所需能最的主要物质
B.蛋白质在淀粉酶的作用下,可水解成葡萄糖等
C.蛋白质水解的最终产物是氨基酸
(2)奶粉中蛋内质含量的国家标准是:每100 g婴幼儿奶粉中含蛋白质1225 g。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨, 由氨的量计算出氮的量,再由氮的量求出蛋白质的含量(蛋白质含氮量按16%计算)。某市质检局取100 g市场中的某个品牌的奶粉样品进行检验。该样品进行反应后生成的![]() 和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L的密闭容器中加入1mol X、0.3molZ和一定量的Y三种气体,一定条件下发生反应,各物质的浓度随时间变化如图一所示,图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
A.Y的起始物质的量为0.5mol
B.该反应化学方程式为:2X(g)+Y(g)![]() 3Z(g) ΔH<0
3Z(g) ΔH<0
C.若t0=0,t1=10min,则t0~t1阶段的平均反应速率为v(Z)=0.03mol·(L·min)-1
D.反应物X的转化率t6点比t3点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
Ⅰ.在25℃、101kPa时,1.00g C6H6(l)燃烧生成CO2和H2O(l)时,放出41.8kJ的热量,表示C6H6(l)燃烧热的热化学方程式为___________________。
Ⅱ.乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g) 2H2O(g)ΔH=-484kJ/mol
OHC-CHO(g)+2H2(g) HOCH2CH2OH(g) ΔH=-78kJ/mol
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) OHC-CHO(g)+2H2O(g)的ΔH=________;相同温度下,该反应的化学平衡常数K=____________(用含K1、K2的代数式表示)。
Ⅲ. 甲醇的合成。
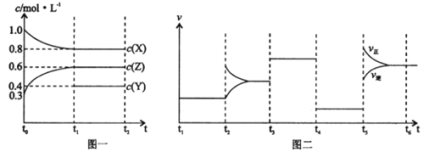
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应如下:CO(g)+2H2(g)CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
①A、B两点对应的压强大小关系是PA________PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是__________。
③下列叙述能说明上述反应能达到化学平衡状态的是______________(填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,经5min达到化学平衡,则用氢气表示该反应的化学速率v(H2)=______,再加入1.0molCO后重新到达平衡,则CO的转化率______(填“增大,不变,减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
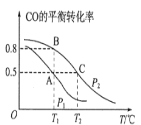
【题目】可逆反应aA(s)+bB(g)![]() cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,以下正确的是( )
cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,以下正确的是( )
A. T1>T2,正反应放热
B. Tl<T2,正反应吸热
C. P1>P2,a+b>c+d
D. Pl<P2,b=c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
A. 11.52 B. 11.70
C. 11.82 D. 12.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场上经常见到的标记为Li-ion的电池。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为: Li+2Li0.35NiO2![]() 2Li0.85NiO2,下列说法正确的是
2Li0.85NiO2,下列说法正确的是
A. 充电时,该电池的正极应外接电源负极
B. 充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C. 该电池既能用酸溶液又能用碱溶液作电解质溶液。
D. 放电过程中Li+向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜电池放电过程的工作原理示意图如下所示,两电极参与反应的物质均含有铜元素![]() 已知:常温下,
已知:常温下,![]() ,
,![]() 。下列说法正确的是
。下列说法正确的是
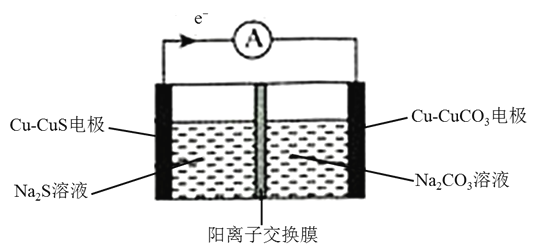
A.当溶液中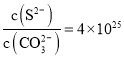 时,电池停止放电
时,电池停止放电
B.![]() 电极为负极,电极反应式为
电极为负极,电极反应式为![]()
C.放电过程中,![]() 溶液的浓度减小
溶液的浓度减小
D.该电池充电时,![]() 从阳离子交换膜的左侧向右侧扩散
从阳离子交换膜的左侧向右侧扩散
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计了一种可以循环利用人体呼出的CO2并提供O2的装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( )
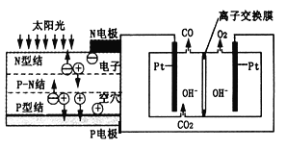
A. 由图分析N电极为电池的正极
B. 阴极的电极反应为CO2+H2O+2e-=CO+2OH-
C. OH-通过离子交换膜迁向左室
D. 反应完毕,该装置中电解质溶液的碱性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com