
【题目】短周期元素A、B、C、D、E原子序数依次增大,A与B或C均能形成10电子分子,B原子的最外层电子数是电子总数的![]() ,C与E同主族,化合物
,C与E同主族,化合物![]() 溶于水生成大量白色胶状沉淀和臭鸡蛋气味气体。下列说法正确的是
溶于水生成大量白色胶状沉淀和臭鸡蛋气味气体。下列说法正确的是
A.气态氢化物的稳定性:E > C
B.A与C形成的10电子分子电子式:![]()
C.A与B形成的18电子分子含有的共价键类型:极性共价键、非极性共价键
D.简单离子半径大小:E > D > C
【答案】C
【解析】
B原子的最外层电子数是电子总数的![]() ,可知B为碳;A与B能形成10电子分子,可知A为氢;化合物
,可知B为碳;A与B能形成10电子分子,可知A为氢;化合物![]() 溶于水有大量白色胶状沉淀和臭鸡蛋气味气体,可知D为铝,E为硫;通过C与E同主族,可知C为氧。
溶于水有大量白色胶状沉淀和臭鸡蛋气味气体,可知D为铝,E为硫;通过C与E同主族,可知C为氧。
A.选项同族非金属性越强,气态氢化物越稳定,故A选项错误;
B.选项中H2O为共价化合物,其电子式:![]() ,故B选项错误;
,故B选项错误;
C.A与B形成的18电子分子为C2H6,含有极性共价键、非极性共价键,故C选项正确;
D.判断离子半径的一般分析方法,一看电子层数,二看核电荷数,三看核外电子总数,O2-与Al3+电子层数都是两层,核电荷数氧元素小于铝元素,所以离子半径O2->Al3+,S2-> O2-,故D选项错误;
故答案选C。


科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+ O2 (g)![]() 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)降低温度,该反应K值______,二氧化硫转化率____,化学反应速度____ ,(以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_____。
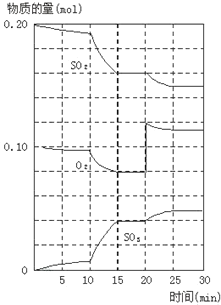
(3)据图判断,反应进行至20min时,曲线发生变化的原因_____(用文字表达)
(4)10min到15min的曲线变化的原因可能是____(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时己知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。

下列说法不正确的是
A.元素甲比Al的最高价氧化物的水化物的碱性弱B.原子半径比较:甲>乙>Si
C.元素乙位于现行元素周期表第四周期第ⅣA族D.推测乙可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】槟榔碱为油状液体,有拟胆碱作用,在医疗上用于治疗青光眼,能使绦虫瘫痪。某学生设计了以X为原料的合成路线如下:
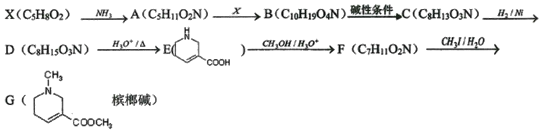
己知:①X能使溴水褪色、能水解,水解产物之一为乙醇。
②
③![]()
(1)槟榔碱中非氮官能团的名称__________,C的结构简式____________。
(2)下列说法正确的是_____________。
A.化合物A能形成内盐
B.化合物C的1H-NMR谱表明含6组峰
C.化合物D有碱性
D.化合物E能溶于水
E.化合物F在一定条件下能发生加聚、氧化、取代等反应
(3)D→E反应的方程式____________。
(4)烟酸![]() 也可以合成槟榔碱。写出烟酸的同分异构体,且符合下列条件的结构简式________。
也可以合成槟榔碱。写出烟酸的同分异构体,且符合下列条件的结构简式________。
①1H-NMR谱表明分子中有3种氢原子
②只含有一个六元环,环上无氧原子,且只有1个取代基
(5)结合题给信息,请设计由乙醇和E![]() 为原料合成化合物M
为原料合成化合物M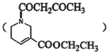 的路线,(用流程图表示,试剂任选)__________________________。
的路线,(用流程图表示,试剂任选)__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求完成下列各题:
(1)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是__________
(2)某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为1∶2∶1, 则溶液中Al3+和SO42-的离子个数比为__________。
(3)将一小块钠投入到盛CuSO4溶液的烧杯中,剧烈反应,放出气体并生成蓝色沉淀,其总反应的离子方程式为________________。
(4)将FeSO4溶液与过量NaOH溶液混合并在空气中放置一段时间,整个过程中的现象为______,反应过程分两步,其中第2步反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计将废金属合金(只含铝、铁、铜)回收再利用制备胆矾、氯化铝晶体和聚合硫酸铁[Fe2(OH)n(SO4)3n/2]m的流程如下图所示,则下列有关叙述中不正确的是( )
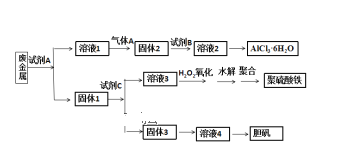
A.本实验中试剂A为氢氧化钠溶液,试剂B盐酸,试剂C为稀硫酸
B.过量气体A与溶液1的反应的离子方程式为:2AlO2- + CO2 + 3H2O = 2Al(OH) 3↓+ CO32-
C.固体3生成溶液4,可能为反应为:2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O
D.溶液3与H2O2反应的化学方程式为:2FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室中称取20gNaOH固体,配制500mL1mol·L-1的氢氧化钠溶液。
(1)该同学准备的实验用品有:托盘天平![]() 带砝码
带砝码![]() 、药匙、量筒、玻璃棒等,还缺少的玻璃仪器有__、__、___。
、药匙、量筒、玻璃棒等,还缺少的玻璃仪器有__、__、___。
(2)下列有关实验操作,正确的是__。(多选)
A.称量氢氧化钠固体时,应该放在称量纸上称量
B.某同学将称量的氢氧化钠固体溶解并冷却至室温,然后转移到容量瓶中
C.某同学在定容时,不小心加水超过刻度线,又将多余的液体吸出直至刻度线
D.某同学在溶解、转移完氢氧化钠溶液后,将溶解用的仪器洗涤2~3次,并将洗涤液转移到容量瓶中
(3)玻璃棒在该实验中的作用有①__,②___。
(4)若实验室遇到下列情况,对氢氧化钠溶液的物质的量浓度有何影响![]() 填“偏高”、“偏低”或“无影响”
填“偏高”、“偏低”或“无影响”![]()
①转移时,有少量的溶液洒落出容量瓶__。
②定容时,容量瓶中事先有洁净的蒸馏水,所配溶液的浓度___。
③定容时俯视溶液的凹液面___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示:
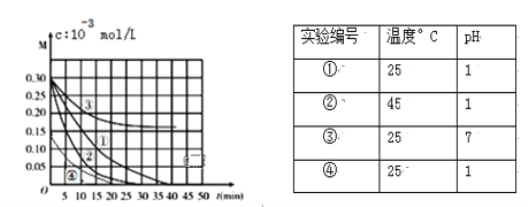
下列说法正确的是
A. 实验①在15 min内M的降解速率为1.33×10-2mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越有利于M的降解
D. 实验②④说明M的浓度越小,降解的速率越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素的单质和化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。回答下列问题:
(1)溴原子的价层电子排布图为_______。根据下表提供的第一电离能数据,判断最有可能生成较稳定的单核阳离子的卤素原子是________(填元素符号)。
氟 | 氯 | 溴 | 碘 | |
第一电离能/ (kJ·mol-1) | 1 681 | 1 251 | 1 140 | 1 008 |
(2)氢氟酸在一定浓度的溶液中主要以二分子缔合[(HF)2]形式存在,使氟化氢分子缔合的相互作用是____________。碘在水中溶解度小,但在碘化钾溶液中明显增大,这是由于发生反应:I-+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质,试写出CsICl2受热分解的化学方程式:_________________________________。
(3)ClO2-中心氯原子的杂化轨道类型为________,与ClO2-具有相同立体构型和键合形式的物质的化学式为____________(写出一个即可)。
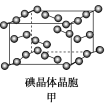
(4)如图甲为碘晶体晶胞结构,平均每个晶胞中有________个碘原子,碘晶体中碘分子的配位数为____________。
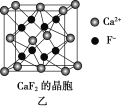
(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρ g·cm-3,其晶胞如图乙所示,两个最近Ca2+核间距离为a nm,则CaF2的相对分子质量可以表示为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com