
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+ O2 (g)![]() 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)降低温度,该反应K值______,二氧化硫转化率____,化学反应速度____ ,(以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_____。
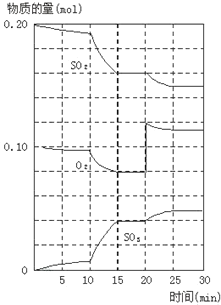
(3)据图判断,反应进行至20min时,曲线发生变化的原因_____(用文字表达)
(4)10min到15min的曲线变化的原因可能是____(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
【答案】增大 增大 减小 15-20min、25-30min 增大氧气的浓度 ab
【解析】
(1)降温,放热反应平衡正移,K增大,反应物转化率增大,速率减小;
(2)各组分的物质的量不变,反应处于平衡状态;
(3)找断点,瞬间只有氧气的浓度增大,应是增大了氧气的浓度;
(4)10min到15min的曲线斜率变大,反应方向不变,且没有出现断点。
(1)该反应正反应为放热反应,降低温度平衡向正反应方向移动,平衡常数K增大,二氧化硫转化率增大,降低温度反应速率减小;
(2)反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态;
(3)由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度;
(4)由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大;且10min改变瞬间,各物质的物质的量不变。
a.加了催化剂,增大反应速率,故a正确;
b.缩小容器体积,增大压强,增大反应速率,故b正确;
c.降低温度反应速率降低,故c错误;
d.10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,故d错误;
答案选ab。


科目:高中化学 来源: 题型:
【题目】我国科学家在金刚石压腔实验中创造出了前所未见的化合物X,在超过113 GPa的压力下能够保持稳定。X在一定条件下完全分解为A(气体)和B,A的密度约为0.18 g·L1;B是短周期中最活泼的金属;Y为含有C元素的气态氧化物,能使品红溶液褪色,E为常见无机物,Y与E以1∶1发生化合反应生成F,F仅含三种元素,是常用的食品抗氧化剂之一(假设反应过程无损耗,题中均为短周期元素,A、B、C为单质,气体数据均为标准状况下测定)。根据如下转化,回答下列问题:
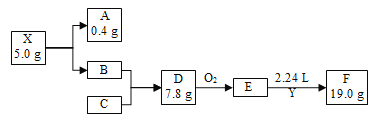
(1) 图中C在元素周期表中的位置是________。
(2) D的电子式为________。
(3) X的化学式为________。
(4) E→F的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经检测,某工业废水显酸性,且废水中含有大量Na+、Cu2+、Cl-、SO42-、NO3-,
(1)下列离子中,不可能大量存在于该废水中的是___(填序号)。
A.K+ B.Fe3+ C.Ag+ D.HCO3-
(2)若向上述废水中加入大量的过氧化钠固体,观察到的现象为___;相关的离子方程式为___。
(3)若工业废水中只含有H+和Na+、Cu2+、Cl-、SO42-、NO3-,经分析测得,H+、Cu2+、Cl-、SO42-、NO3-的物质的量浓度分别为:0.1mol·L-1、0.05mol·L-1、0.2mol·L-1、0.1mol·L-1、0.1mol·L-1,则Na+的物质的量浓度为___。
(4)设计实验方案除去原废水中的Cu2+和SO42-(用流程图表示)(提示:加入的试剂要过量)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)![]() 2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )
2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )
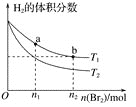
A.由图可知:T1>T2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-。下列说法不正确的是
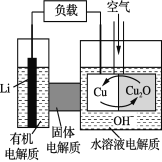
A. 放电时,Li+透过固体电解质向Cu极移动
B. 通空气时,铜被腐蚀,产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+2H+ +2 e- ===2Cu+H2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述正确的是( )
A. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
B. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
C. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
D. 39g钾与氧气完全反应,生成K2O转移NA个电子,生成KO2转移2NA电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表达正确的是( )
A.羟基的电子式:![]()
B.乙烯结构简式:CH2CH2
C.R2+离子核外有a个电子,b个中子,R原子表示为:![]() R
R
D.NaClO的电离方程式:NaClO=Na++Cl-+O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①NaHCO3;②C2H5OH;③Cu;④H2O;⑤石灰乳;⑥CO;⑦Ba(OH)2;⑧盐酸;⑨H2CO3;⑩浓硝酸。
(1)属于电解质的是___(填写序号),属于非电解质的是___(填写序号)。
(2)⑨在水溶液中的电离方程式为___。
(3)⑤与⑧反应的离子方程式为___。
(4)向⑦的溶液中滴加①的溶液至Ba2+恰好完全沉淀,离子方程式为___。
(5)③与⑩反应的离子方程式如下,请配平方程式(在中填入系数,在横线上写上缺少的物质),并用“单线桥”标出电子转移的方向与数目。___
Cu+NO3-+ —Cu2++NO2↑+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E原子序数依次增大,A与B或C均能形成10电子分子,B原子的最外层电子数是电子总数的![]() ,C与E同主族,化合物
,C与E同主族,化合物![]() 溶于水生成大量白色胶状沉淀和臭鸡蛋气味气体。下列说法正确的是
溶于水生成大量白色胶状沉淀和臭鸡蛋气味气体。下列说法正确的是
A.气态氢化物的稳定性:E > C
B.A与C形成的10电子分子电子式:![]()
C.A与B形成的18电子分子含有的共价键类型:极性共价键、非极性共价键
D.简单离子半径大小:E > D > C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com