
【题目】在体积均为1.0 L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A.化学平衡常数K:K(状态I)<K(状态II)<K(状态III)
B.CO2的平衡转化率α:α(状态I)<α(状态Ⅱ)=α(状态III)
C.体系中c(CO):c (CO,状态Ⅱ)<2c (CO,状态Ⅲ)
D.逆反应速率υ逆:υ逆(状态Ⅰ)>υ逆(状态Ⅲ)
【答案】C
【解析】
A、状态II、III温度相同,K(状态II)=K(状态III),根据图像,升高温度,平衡时c(CO2)减小,平衡正向移动,K增大,K(状态I) <K(状态III),故A错误;
B、状态Ⅰ、III所在曲线是通入0.1molCO2,根据图像,升高温度,平衡时c(CO2)减小,平衡正向移动,故α(状态I)<α(状态III),状态Ⅱ所在曲线是通入0.2molCO2,状态II、III温度相同,状态II相当于在状态III的基础上加压,增大压强,平衡逆向移动,CO2的平衡转化率减小,α(状态Ⅱ)<α(状态III),故B错误;
C、状态III所在曲线是通入0.1molCO2,状态Ⅱ所在曲线是通入0.2molCO2,状态II、III温度相同,状态II相当于在状态III的基础上加压,将体积缩小为原来的一半,增大压强,若平衡不移动,则浓度为2倍,而增大压强,平衡逆向移动,因此c(CO,状态Ⅱ)<2c(CO,状态Ⅲ),故C正确;
D、温度越高,反应速率越快,υ逆(状态Ⅰ)<υ逆(状态Ⅲ),故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】以黄铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
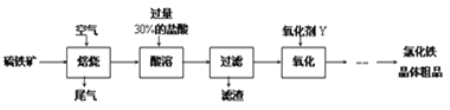
请按要求回答下列问题:
(1)需将硫铁矿粉碎再焙烧的目的是______________________________________.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是_____________、__________.
(3)尾气主要含N2、O2、SO2和少量的CO2、H2O(g).测定尾气中SO2含量的方案如下:
(方案甲)将标准状况下的2.24 L尾气缓慢通过如下装置A中:
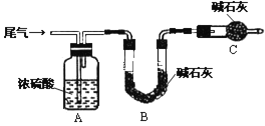
①C仪器的名称是_______________,装置C的作用是_________________________.
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量SO2的体积分数,请写出该方案合理与否的理由__________________________________________.
(方案乙)将标准状况下的2.24 L尾气缓慢通过如下装置D中,充分与足量试剂M反应后,再滴入过量试剂N,经过滤、洗涤、干燥、用电子天平称得沉淀质量为0.233g.
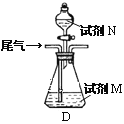
③若试剂M、N分别是碘水、BaCl2溶液,写出D中总反应的离子方程式: __________________.尾气中SO2的体积分数为__________________.
④若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色.写出SO2和Ba(NO3)2溶液反应的离子方程式:___________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法错误的是
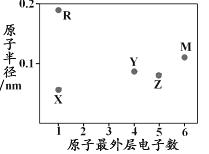
A. R的氧化物含有离子键 B. 最高价含氧酸的酸性:Z<Y
C. M的氢化物常温常压下为气体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜改革国外的制碱工艺,发明了著名的联合制碱法,其生产流程如下图所示。请根据工艺流程,回答下列问题。

![]() 沉淀池中发生反应的化学方程式是________。该工艺流程中,首先向沉淀池中加入足量饱和食盐水,然后先通入________
沉淀池中发生反应的化学方程式是________。该工艺流程中,首先向沉淀池中加入足量饱和食盐水,然后先通入________![]() 填化学式
填化学式![]() ,再通入________
,再通入________![]() 填化学式
填化学式![]() ,使得固体B结晶析出。
,使得固体B结晶析出。
![]() 请设计实验检验固体产品C中是否含有氯化钠。
请设计实验检验固体产品C中是否含有氯化钠。![]() 默认产品中的阳离子均为钠离子
默认产品中的阳离子均为钠离子![]() _________。
_________。
![]() 向母液中通入氨气并加入细小的食盐颗粒,可冷却析出副产品D,其化学式为________,剩余母液可循环利用。
向母液中通入氨气并加入细小的食盐颗粒,可冷却析出副产品D,其化学式为________,剩余母液可循环利用。
![]() 煅烧炉中发生反应的化学方程式是________。所得产品C中往往还含有少量未反应的固体B。若称取mg产品并加热至恒重,剩余固体质量为
煅烧炉中发生反应的化学方程式是________。所得产品C中往往还含有少量未反应的固体B。若称取mg产品并加热至恒重,剩余固体质量为![]() ,则产品中物质C的质量分数为________。
,则产品中物质C的质量分数为________。
![]() 将提纯后纯净的物质B与
将提纯后纯净的物质B与![]() 以
以![]() 物质的量之比
物质的量之比![]() 混合,置于一密闭容器内共热
混合,置于一密闭容器内共热![]() 加热前容器内只含有固体混合物和氮气
加热前容器内只含有固体混合物和氮气![]() 。充分反应后将剩余固体物质干燥并测定其组成。干燥后固体物质的主要成分是_____
。充分反应后将剩余固体物质干燥并测定其组成。干燥后固体物质的主要成分是_____![]() 填化学式
填化学式![]() ,次要成分是________
,次要成分是________![]() 填化学式
填化学式![]() ,主要成分与次要成分的物质的量之比为________。
,主要成分与次要成分的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴可正确表示原子轨道的是___。
A.2s B.2d C.3p D.3f
⑵写出基态镓(Ga)原子的电子排布式:___。
⑶下列物质变化,只与范德华力有关的是___。
A.干冰熔化 B.乙酸汽化 C.乙醇与丙酮混溶 D.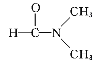 溶于水
溶于水
E.碘溶于四氯化碳 F.石英熔融
⑷下列物质中,只含有极性键的分子是___,既含离子键又含共价键的化合物是___;只存在σ键的分子是___,同时存在σ键和π键的分子是___。
A.N2 B.CO2 C.CH2Cl2 D.C2H4 E.C2H6 F.CaCl2 G.NH4Cl
⑸用“>”“<”或“=”填空:
第一电离能的大小:Mg___Al;熔点的高低:KCl___MgO。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
A.900℃,该反应的平衡常数K<1
B.850℃达到平衡时,通入CO,CO转化率将增大
C.850℃时,若x=5.0,则起始时平衡向逆反应方向移动
D.850℃时,若要使上述反应开始时向正反应方向进行,则![]() 应满足0≤x<3
应满足0≤x<3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)盛装MnO2的仪器名称:_____
(2)实验室制氯气的反应原理为:__HCl(浓)+__MnO2 =加热=__MnCl2+__Cl2↑+__H2O(请将方程式中反应系数补充完整)
(3)盛有饱和食盐水的洗气瓶的作用是______.
(4)装置B中盛放的试剂是______(填选项),实验现象为______.
a.Na2S溶液b.Na2SO3溶液c.Na2SO4溶液
(5)装置C中盛放烧碱稀溶液,目的是______.
(6)能证明氯元素比硫元素非金属性强的依据为______.(填序号)
①氯原子比硫原子更容易获得电子形成离子;
②次氯酸的氧化性比稀硫酸强;
③S2-比Cl-还原性强;
④HCl比H2S稳定.
查看答案和解析>>
科目:高中化学 来源: 题型:
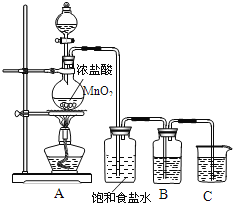
【题目】电石法(乙炔法)制氯乙烯是最早完成工业化的生产氯乙烯的方法。
反应原理为HC≡CH+HCl![]() CH2=CHCl(HgCl2/活性炭作催化剂)。某学习小组的同学用下列装置测定该反应中乙炔的转化率(不考虑其他副反应)。铁架台及夹持仪器未画出。(已知
CH2=CHCl(HgCl2/活性炭作催化剂)。某学习小组的同学用下列装置测定该反应中乙炔的转化率(不考虑其他副反应)。铁架台及夹持仪器未画出。(已知![]() 的熔点为-159.8℃,沸点为-134℃。乙炔、氯乙烯、氯化氢均不溶于液体A)
的熔点为-159.8℃,沸点为-134℃。乙炔、氯乙烯、氯化氢均不溶于液体A)
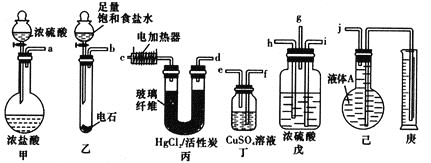
(1)各装置的连接顺序为(箭头方向即为气流方向):_________→________→_________→h→_________→______→_________→__________
(2)戊装置除了均匀混合气体之外,还有_________和_________的作用。
(3)乙装置中发生反应的化学方程式为_________________________________。
(4)若实验所用的电石中含有1.28gCaC2,甲装置中产生0.02mol的HCl气体。则所选用的量筒的容积较合理的是_______![]() 填字母代号
填字母代号![]() 。
。
A.500ml B.1000ml C.2000ml
(5)假定在标准状况下测得庚中收集到的液体A的体积为672ml(导管内气体体积忽略不计),则乙炔的转化率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.已知:![]()
![]() ,由此可知
,由此可知![]() 气体在密闭容器中分解后可以放出
气体在密闭容器中分解后可以放出![]() 的热量
的热量
B.已知:![]()
![]() ,则氢气的燃烧热
,则氢气的燃烧热![]()
C.肼![]() 是一种用于制造火箭燃料或燃料电池的原料,已知
是一种用于制造火箭燃料或燃料电池的原料,已知![]()
![]()
![]() ;
;![]()
![]()
![]() ,则有反应:
,则有反应:![]()
![]()
D.含![]() 的稀溶液与稀盐酸完全中和,放出
的稀溶液与稀盐酸完全中和,放出![]() 的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为
的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为![]()
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com