
【题目】下列物质的转化在给定条件下能实现的是
①![]()
②![]()
③![]()
④![]()
⑤![]()
⑥![]()
A.①②⑤B.②③⑥C.②⑤⑥D.①③④
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A. CH3OH(l)的燃烧热为1 452 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)===
Ba(OH)2(aq)===![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实验为基础的科学。请回答下列问题:
(1)利用如图装置可验证浓、稀硝酸氧化性强弱,请完成 实验操作,回答相关问题:
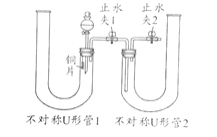
①实验操作过程:固定铜片,打开分液漏斗活塞及止水夹2,从不对称U形管1、2长管口处分别注入稀硝酸、浓硝酸,液面与双孔橡皮塞接触,然后,关闭分液漏斗玻璃活塞、止水夹1、2。此后可观察到现象______;然后打开止水夹1,会发现不对称U形管2中长导管口无色气泡变红棕色,浓硝酸逐渐变黄(说明稀硝酸不能氧化这种无色气体而浓硝酸可以)。
②请用一个化学方程式体现该实验验证浓、稀硝酸氧化性强弱的原理_________。
(2)利用如图装置可以验证非金属性的变化规律。
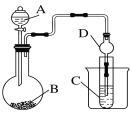
①干燥管D的作用是__________。
②实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B中所装药品分别为________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为______________________。
③若要证明非金属性:Cl > C >Si,则A中加入试剂____________、B中加Na2CO3、C中加入试剂______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
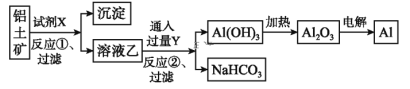
下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_______________________________________________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为_______________。
II.A、B、C、D均为中学化学常见的纯净物,A是单质。
它们之间有如下的反应关系:
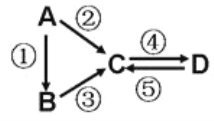
(3)若A是淡黄色单质固体,C、D是氧化物,且C是造成酸雨的主要物质。则C与另一种淡黄色物质反应的化学方程式______________________________________。
(4)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是________________。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测定H2C2O4·xH2O 中x值: 已知:M(H2C2O4)=90 g·mol-1
①称取 1.260 g H2C2O4·xH2O晶体,将其配成100.00 mL 水溶液为待测液;
②量取 25.00mL 待测液放入锥形瓶中,再加入适量的稀H2SO4;
③用20.00ml浓度为 0.05000 mol·L-1的 KMnO4标准溶液进行滴定。
(提示:H2C2O4被氧化为CO2 , KMnO4被还原为MnSO4)
(1)请写出与滴定有关反应的化学方程式______________。
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是_____(选填 a、b)。
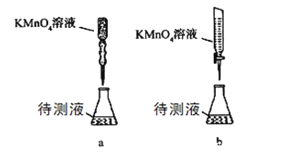
(3)滴定过程中眼睛应注视______________________。
(4)通过上述数据,求得x=____________。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果______(偏大、偏小或没有影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一块11.0 g的铁铝合金,加入一定量的稀硫酸后合金完全溶解,然后加H2O2到溶液中无Fe2+存在,加热除去多余的H2O2,当加入200 mL 6 molL﹣1NaOH溶液时沉淀量最多,且所得沉淀质量为26.3 g,下列说法不正确的是
A.该合金中铁的质量为5.6 g
B.合金与稀硫酸反应共生成0.45 mol H2
C.该合金与足量氢氧化钠反应,转移的电子数为0.6 NA
D.所加的稀硫酸中含0.6 mol H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下常压下,1g固态碳与水蒸气恰好完全反应,反应生成气体CO和H2,吸收10.94kJ热量,此反应的热化学方程式为___。
(2)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-Q1kJ·mol-1,
②2H2(g)+O2(g)=2H2O(g) ΔH2=-Q2kJ·mol-1,
③2H2(g)+O2(g)=2H2O(l) ΔH3=-Q3kJ·mol-1。
常温下,取体积比4∶1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为___kJ。
(3)以H2为燃料可制成氢氧燃料电池。已知:2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1,某氢氧燃料电池释放228.8kJ电能时,生成1mol液态水,该电池的能量转化率为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com