
【题目】(1)常温下常压下,1g固态碳与水蒸气恰好完全反应,反应生成气体CO和H2,吸收10.94kJ热量,此反应的热化学方程式为___。
(2)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-Q1kJ·mol-1,
②2H2(g)+O2(g)=2H2O(g) ΔH2=-Q2kJ·mol-1,
③2H2(g)+O2(g)=2H2O(l) ΔH3=-Q3kJ·mol-1。
常温下,取体积比4∶1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为___kJ。
(3)以H2为燃料可制成氢氧燃料电池。已知:2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1,某氢氧燃料电池释放228.8kJ电能时,生成1mol液态水,该电池的能量转化率为___。
【答案】C(s)+H2O(g)═CO(g)+H2(g) △H=+131.28kJmol-1; 0.4Q1+0.05Q3 80%
【解析】
(1)由1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,则1mol碳与水蒸气反应,吸收10.94KJ×12=131.28kJ,并注意物质的状态来解答;
(2)根据混合气体的体积计算混合气体的物质的量,结合气体体积比计算甲烷、氢气的物质的量,再根据热化学反应方程式计算放出的热量,注意燃烧后恢复至常温,氢气燃烧放出的热量应选择生成液态水的热化学反应方程式计算;
(3)先根据热化学方程式求出生成1mol液态水,理论上放出的能量,然后根据电池的能量转化率=![]() ×100%。
×100%。
(1)由1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,则1mol碳与水蒸气反应,吸收10.94KJ×12=131.28kJ,则此反应的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g) △H=+131.28kJmol-1,故答案为:C(s)+H2O(g)═CO(g)+H2(g) △H=+131.28kJmol-1;
(2)甲烷和氢气的混合气体11.2L(已折合成标准状况),所以甲烷和氢气的混合气体的总的物质的量为=![]() =0.5mol,甲烷和氢气的体积比为4:1,所以甲烷的物质的量为0.5mol×
=0.5mol,甲烷和氢气的体积比为4:1,所以甲烷的物质的量为0.5mol×![]() =0.4mol,氢气的物质的量为0.5mol-0.4mol=0.1mol,由CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H=-Q1kJ/mol可知,0.4mol甲烷燃烧放出的热量为0.4mol×Q1kJ/mol=0.4Q1kJ;由2H2(g)+O2(g)═2H2O(l) △H=-Q3kJ/mol可知,0.1mol氢气燃烧生成液态水放出的热量为0.1mol×
=0.4mol,氢气的物质的量为0.5mol-0.4mol=0.1mol,由CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H=-Q1kJ/mol可知,0.4mol甲烷燃烧放出的热量为0.4mol×Q1kJ/mol=0.4Q1kJ;由2H2(g)+O2(g)═2H2O(l) △H=-Q3kJ/mol可知,0.1mol氢气燃烧生成液态水放出的热量为0.1mol×![]() ×Q3kJ/mol=0.05Q3kJ,所以放出的热量为(0.4Q1+0.05Q3)kJ,故答案为:0.4Q1+0.05Q3;
×Q3kJ/mol=0.05Q3kJ,所以放出的热量为(0.4Q1+0.05Q3)kJ,故答案为:0.4Q1+0.05Q3;
(3)生成1mol液态水,理论上放出的能量为![]() =286kJ,电池的能量转化率=
=286kJ,电池的能量转化率=![]() ×100%=
×100%=![]() ×100%=80%,故答案为:80%。
×100%=80%,故答案为:80%。


科目:高中化学 来源: 题型:
【题目】常温时,向10 mL浓度为0.01mol/L的氨水溶液中逐滴加入0.01mol/L的CH3COOH溶液,混合液的pH 与加入CH3COOH 的体积V之间的变化曲线如下图所示。下列说法正确的是
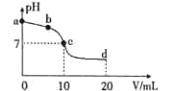
A. a点溶液的pH=12
B. b点时c(CH3COO-)>c(NH4+)
C. c点时水的电离程度最大
D. d点处微粒间存在:2c(H+)+c(CH3COO-)=2c(OH-)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是植物秸秆的主要成分,以A为原料在一定条件下可获得多种有机物,它们的相互转化关系如图所示。已知F是一种最简单的烯烃。请回答:

(1)F→C的反应类型是___。
(2)D的官能团名称为___。
(3)C+E→G的化学方程式是___。
(4)下列说法正确的是__。
A.D能被氧化成E,但不能被还原成C
B.实验室制备G时可用浓硫酸作催化剂和吸水剂
C.B、C、E三种物质可以用新制氢氧化铜悬浊液鉴别
D.相同质量的B、G完全燃烧生成水的质量相等
E.SO2气体与F均能使溴水褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出以下物质的电子式:
Na2O2:___;H2S:___;NaHS:___。
(2)用“>”或“<”回答下列问题:
酸性:H2SiO3___H3PO4;稳定性:HCl___CH4;氧化性:Cu2+___Fe3+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中不正确的是( )
A. 标况下,22.4L C2H2 中所含的 π 键数和 18g 冰中所含的氢键数均为 2NA
B. 双原子或多原子形成的气体单质中,一定有 σ 键,可能有 π 键
C. NH4+与 H3O + 均为 10 电子粒子,它们互为等电子体
D. 一个 P4S3 分子(结构如图)中含有三个非极性共价键

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是________________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于___________(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______;Fe(CO)x在一定条件下发生反应:Fe(CO)x(s)![]() Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
(3)写出CO的一种常见等电子体分子的结构式____________;两者相比较沸点较高的为__________(填化学式)。CN-中碳原子杂化轨道类型为__________,C、N、O三元素的第一电离能最大的为_______(用元素符号表示)。
(4)铜与Cl形成化合物的晶胞如图所示(黑点代表铜原子)。
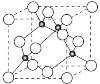
①该晶体的化学式为________。它可与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,反应的化学方程式为___________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于______(填“离子”、“共价”)化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是制取氯气并以氯气为原料进行特定反应的装置,请回答下列问题:
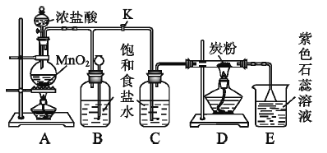
(1)A是制取氯气的发生装置,发生反应的离子方程式为_________。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让![]() 充满整个装置,再点燃D处的酒精灯,
充满整个装置,再点燃D处的酒精灯,![]() 通过C瓶后再进入D(D装置的硬质玻璃管内盛有炭粉)发生氧化还原反应其产物为
通过C瓶后再进入D(D装置的硬质玻璃管内盛有炭粉)发生氧化还原反应其产物为![]() 和
和![]() 。D中发生反应的化学方程式为_______,装置C的作用是_________。
。D中发生反应的化学方程式为_______,装置C的作用是_________。
(3)E处溶液的颜色由紫色变为红色,再变为无色,请解释溶液由红色变为无色的原因_______,若将E处烧杯中的溶液改为硝酸银溶液,发生反应的离子方程式为________。
(4)D处反应完毕后关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有![]() 产生,此时B中出现的现象是_________。
产生,此时B中出现的现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究铝片与Na2CO3溶液的反应,下列说法不正确的是( )
|
| |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
A.对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
B.Na2CO3溶液中存在平衡:CO32-+H2O![]() HCO3- +OH-
HCO3- +OH-
C.加热和H2逸出对CO32-水解平衡移动方向的影响是相反的
D.推测出现白色浑浊的原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com