
【题目】下图是制取氯气并以氯气为原料进行特定反应的装置,请回答下列问题:
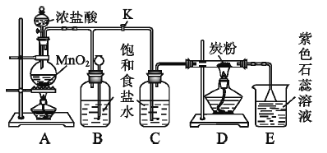
(1)A是制取氯气的发生装置,发生反应的离子方程式为_________。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让![]() 充满整个装置,再点燃D处的酒精灯,
充满整个装置,再点燃D处的酒精灯,![]() 通过C瓶后再进入D(D装置的硬质玻璃管内盛有炭粉)发生氧化还原反应其产物为
通过C瓶后再进入D(D装置的硬质玻璃管内盛有炭粉)发生氧化还原反应其产物为![]() 和
和![]() 。D中发生反应的化学方程式为_______,装置C的作用是_________。
。D中发生反应的化学方程式为_______,装置C的作用是_________。
(3)E处溶液的颜色由紫色变为红色,再变为无色,请解释溶液由红色变为无色的原因_______,若将E处烧杯中的溶液改为硝酸银溶液,发生反应的离子方程式为________。
(4)D处反应完毕后关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有![]() 产生,此时B中出现的现象是_________。
产生,此时B中出现的现象是_________。
【答案】![]()
![]() 吸收Cl2中的HCl气体,提供D处反应所需的水蒸气 Cl2与H2O反应生成的HClO有漂白性
吸收Cl2中的HCl气体,提供D处反应所需的水蒸气 Cl2与H2O反应生成的HClO有漂白性 ![]() 瓶中液面下降,长颈漏斗中液面上升,瓶中贮存少量黄绿色气体。
瓶中液面下降,长颈漏斗中液面上升,瓶中贮存少量黄绿色气体。
【解析】
(1)根据装置图中反应物是浓盐酸和二氧化锰来判断生成物,从而确定方程式;
(2)氯气有强氧化性,碳有还原性,在加热条件下氯气和水、碳发生氧化还原反应;氯化氢气体极易溶于水,且水能提供水蒸气;
(3)氯气与水反应生成盐酸和次氯酸,遇紫色石蕊试液会先变红后褪色;氯水与硝酸银溶液反应生成白色沉淀;
(4)根据B装置内气体的压强变化分析液面变化。B装置可贮存少量Cl2
(1)A装置中浓盐酸和二氧化锰在加热条件下能发生氧化还原反应,产物为氯化锰、氯气、水,故反应的离子方程式为:![]() ;
;
(2)A装置产生了氯气,C装置为D装置提供水蒸气,氯气有强氧化性,碳有还原性,在加热条件下氯气和水、碳发生氧化还原反应生成氯化氢和二氧化碳,反应的化学方程式为:![]() ;盐酸有挥发性,所以制取的氯气中含有氯化氢气体,氯化氢极易溶于水,通过以上分析知,C装置的作用是:吸收Cl2中的HCl气体,提供D处所需水蒸气,故答案为:
;盐酸有挥发性,所以制取的氯气中含有氯化氢气体,氯化氢极易溶于水,通过以上分析知,C装置的作用是:吸收Cl2中的HCl气体,提供D处所需水蒸气,故答案为:![]() ;吸收Cl2中的HCl气体,提供D处所需水蒸气;
;吸收Cl2中的HCl气体,提供D处所需水蒸气;
(3)剩余的氯气在E装置中和水反应生成盐酸和次氯酸,所以溶液呈酸性,紫色石蕊试液遇酸变红色,次氯酸有漂白性,能使溶液褪色;若将E处烧杯中的溶液改为硝酸银溶液,溶液中会出现白色沉淀,发生反应的离子方程式为: ![]() 。故答案为:Cl2与H2O反应生成的HClO有漂白性;
。故答案为:Cl2与H2O反应生成的HClO有漂白性;![]() ;
;
(4)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,气体通过导管进入B装置,导致B装置中气体的压强增大,使瓶中液面下降,长颈漏斗内液面上升;饱和食盐水能抑制氯气的溶解, B装置可贮存少量Cl2。故答案为:瓶中液面下降,长颈漏斗中液面上升,瓶中贮存少量黄绿色气体。


科目:高中化学 来源: 题型:
【题目】一块11.0 g的铁铝合金,加入一定量的稀硫酸后合金完全溶解,然后加H2O2到溶液中无Fe2+存在,加热除去多余的H2O2,当加入200 mL 6 molL﹣1NaOH溶液时沉淀量最多,且所得沉淀质量为26.3 g,下列说法不正确的是
A.该合金中铁的质量为5.6 g
B.合金与稀硫酸反应共生成0.45 mol H2
C.该合金与足量氢氧化钠反应,转移的电子数为0.6 NA
D.所加的稀硫酸中含0.6 mol H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下常压下,1g固态碳与水蒸气恰好完全反应,反应生成气体CO和H2,吸收10.94kJ热量,此反应的热化学方程式为___。
(2)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-Q1kJ·mol-1,
②2H2(g)+O2(g)=2H2O(g) ΔH2=-Q2kJ·mol-1,
③2H2(g)+O2(g)=2H2O(l) ΔH3=-Q3kJ·mol-1。
常温下,取体积比4∶1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为___kJ。
(3)以H2为燃料可制成氢氧燃料电池。已知:2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1,某氢氧燃料电池释放228.8kJ电能时,生成1mol液态水,该电池的能量转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷、甲烷、乙醛的混合气体在同温同压下和CO2的密度相同,则三种气体的体积比可能是( )
①2:1:4 ②5:2:1 ③2:5:1 ④6:3:2 ⑤4:2:3
A. ①②B. ②③C. ③④⑤D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来甲醇用途日益广泛,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2L密闭刚性的容器内,加入物质的量之比为![]() 的
的![]() 和
和![]() ,400℃时反应:
,400℃时反应:![]()
体系中![]() 随时间的变化如下表:
随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
| 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)用![]() 表示从0~2s内该反应的平均速率
表示从0~2s内该反应的平均速率![]() _______________。
_______________。
(2)能说明该反应已达到平衡状态的是_______________。
a.![]() b.容器内压强保持不变
b.容器内压强保持不变
c.![]() d.容器内密度保持不变
d.容器内密度保持不变
(3)达到平衡时,甲醇在平衡体系中的体积分数为__________(保留小数点后一位)。
(4)![]() 与
与![]() 的反应可将化学能转化为电能,若用硫酸做电解质溶液形成原电池,
的反应可将化学能转化为电能,若用硫酸做电解质溶液形成原电池,![]() 应通入电池的_________极(“正”、“负”),且正极的电极反应式为_____________。
应通入电池的_________极(“正”、“负”),且正极的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)① 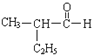 系统命名为______,与银氨溶液反应的化学方程式为__________
系统命名为______,与银氨溶液反应的化学方程式为__________
②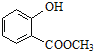 中含有的官能团的名称为_____.
中含有的官能团的名称为_____.
(2)戊基有_____种结构,请写出其中的核磁共振氢谱有二个吸收峰的结构简式______.
(3)糖类、油脂、蛋白质都是人体必需的营养物质。下列物质中①葡萄糖②麦芽糖③蔗糖④纤维素⑤淀粉,互为同分异构体的是___;具有还原性,能发生银镜反应的是___.(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O。下列说法正确的是( )
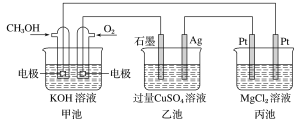
A. 1min内甲池消耗1mol O2转移的电子是乙池Ag电极转移电子数的4倍
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 其一种单质可吸收紫外线,是地球的保护伞 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
(1)B元素符号为___,G的元素名称为___,它的一种同位素可测定文物年代,这种同位素的符号是___。
(2)A与C以原子个数比为1:1形成的一种化合物,其所属化合物类型为___(填“离子化合物”或“共价化合物”),包含的化学键有__(填“离子键”、“极性共价键”或“非极性共价键”)。
(3)F常温下可以形成两种用途广泛的氢化物,它们的电子式分别为__和__,并用电子式表示出其最简单气态氢化物的形成过程___。
(4)D在元素周期表中的位置__,D与E相比非金属性较强的是__(填元素名称),请从原子结构的角度解释原因:__。
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·H2O)的电离常数为Kb,且pKb=-lgKb =3.38。常温下,在体积均为20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。下列说法正确的是
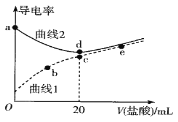
A. 曲线1代表四甲基氢氧化铵溶液
B. 在b、c、e三点中,水的电离程度最大的点是e
C. b点溶液中:c(Cl-)=c(CH3NH3+)+c(CH3NH2·H2O)
D. 常温下,CH3NH3Cl水解常数的数量级为10-11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com