
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O。下列说法正确的是( )
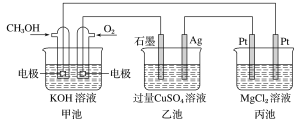
A. 1min内甲池消耗1mol O2转移的电子是乙池Ag电极转移电子数的4倍
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
【答案】D
【解析】
由装置示意图可知,甲池是CH3OH燃料电池,是化学能能转化为电能的装置,乙、丙池是电解池,是将电能能转化为化学能的装置。
A项、1min内甲池消耗1mol O2,反应转移的电子为4mol,甲池和乙池中,转移的电子数目相等,乙池Ag电极为阴极, 转移的也为4mol,析出2molCu,故A错误;
B项、甲池是燃料电池,CH3OH燃料通入的极是电池的负极,发生氧化反应,因电解质是氢氧化钾,所以电极反应不会生成氢离子,故B错误;
C项、电解硫酸铜时,阳极放氧气,阴极析出金属铜,所以要让电解质在电解后复原,应加入氧化铜,故C错误;
D项、丙池中电解氯化镁溶液,电解的离子方程式为Mg2++2Cl-+2H2O ![]() H2↑+Cl2↑+Mg(OH)2↓,甲池中标准状况下消耗280mLO2的物质的量为0.0125mol,转移的电子为0.05mol,此时析出氢氧化镁的物质的量为58g/mol×0.025mol=1.45g,故D正确.
H2↑+Cl2↑+Mg(OH)2↓,甲池中标准状况下消耗280mLO2的物质的量为0.0125mol,转移的电子为0.05mol,此时析出氢氧化镁的物质的量为58g/mol×0.025mol=1.45g,故D正确.
故选D。


科目:高中化学 来源: 题型:
【题目】常温时,向10 mL浓度为0.01mol/L的氨水溶液中逐滴加入0.01mol/L的CH3COOH溶液,混合液的pH 与加入CH3COOH 的体积V之间的变化曲线如下图所示。下列说法正确的是
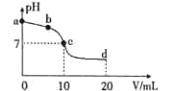
A. a点溶液的pH=12
B. b点时c(CH3COO-)>c(NH4+)
C. c点时水的电离程度最大
D. d点处微粒间存在:2c(H+)+c(CH3COO-)=2c(OH-)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是________________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于___________(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______;Fe(CO)x在一定条件下发生反应:Fe(CO)x(s)![]() Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
(3)写出CO的一种常见等电子体分子的结构式____________;两者相比较沸点较高的为__________(填化学式)。CN-中碳原子杂化轨道类型为__________,C、N、O三元素的第一电离能最大的为_______(用元素符号表示)。
(4)铜与Cl形成化合物的晶胞如图所示(黑点代表铜原子)。
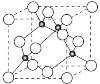
①该晶体的化学式为________。它可与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,反应的化学方程式为___________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于______(填“离子”、“共价”)化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是制取氯气并以氯气为原料进行特定反应的装置,请回答下列问题:
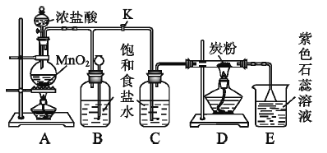
(1)A是制取氯气的发生装置,发生反应的离子方程式为_________。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让![]() 充满整个装置,再点燃D处的酒精灯,
充满整个装置,再点燃D处的酒精灯,![]() 通过C瓶后再进入D(D装置的硬质玻璃管内盛有炭粉)发生氧化还原反应其产物为
通过C瓶后再进入D(D装置的硬质玻璃管内盛有炭粉)发生氧化还原反应其产物为![]() 和
和![]() 。D中发生反应的化学方程式为_______,装置C的作用是_________。
。D中发生反应的化学方程式为_______,装置C的作用是_________。
(3)E处溶液的颜色由紫色变为红色,再变为无色,请解释溶液由红色变为无色的原因_______,若将E处烧杯中的溶液改为硝酸银溶液,发生反应的离子方程式为________。
(4)D处反应完毕后关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有![]() 产生,此时B中出现的现象是_________。
产生,此时B中出现的现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药用有机物A为一种无色液体,从A出发可发生如下一系列反应:
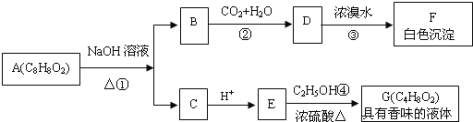
请回答:
(1)E中的官能团名称是_________。
(2)A的结构简式为_________。
(3)写出反应①的化学方程式:_____________,该反应的反应类型是_________。
(4)写出反应③的化学方程式:______________________。
(5)符合下列条件的A的同分异构体有_____(不考虑立体异构)种,写出其中一种的结构简式:______________。
①苯环上有两个取代基 ②能发生水解反应 ③能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A. B的结构可能有3种,其中一种名称为2,2,3-三甲基-2-戊烯
B. 用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C. 有机物A的分子式为C8H18
D. 有机物A的一氯取代物只有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究铝片与Na2CO3溶液的反应,下列说法不正确的是( )
|
| |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
A.对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
B.Na2CO3溶液中存在平衡:CO32-+H2O![]() HCO3- +OH-
HCO3- +OH-
C.加热和H2逸出对CO32-水解平衡移动方向的影响是相反的
D.推测出现白色浑浊的原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g) + O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A. 甲中反应的平衡常数小于乙
B. 平衡时,丙中c(SO3)是甲中的2倍
C. 该温度下,平衡常数值为400
D. 平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com