
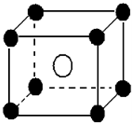
 某离子晶体晶胞如图所示,阳离子 X(●)位于立方体的顶点,阴离子Y(○)位于立方体的中心,试分析:
某离子晶体晶胞如图所示,阳离子 X(●)位于立方体的顶点,阴离子Y(○)位于立方体的中心,试分析:| 1 |
| 8 |
| M |
| NA |
| M |
| NA?ρ |
| 3 |
| ||
| 3 |
| ||


 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)一定条件下,发生反应CO(g)+H2O(g)?CO2(g)+H2(g),向2L密闭容器中通入2mol CO(g)、1mol H2O(g),2min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为
(1)一定条件下,发生反应CO(g)+H2O(g)?CO2(g)+H2(g),向2L密闭容器中通入2mol CO(g)、1mol H2O(g),2min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解时阳极得到Br2,阴极得到NaOH和H2 |
| B、若取阳极附近的溶液中滴入淀粉溶液,溶液呈蓝色 |
| C、若取阴极附近的溶液中滴入酚酞试液,溶液变红色 |
| D、若取阳极附近的溶液少量于试管中,滴入少量的苯,振荡静置后上层溶液呈橙红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com