
 (1)一定条件下,发生反应CO(g)+H2O(g)?CO2(g)+H2(g),向2L密闭容器中通入2mol CO(g)、1mol H2O(g),2min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为
(1)一定条件下,发生反应CO(g)+H2O(g)?CO2(g)+H2(g),向2L密闭容器中通入2mol CO(g)、1mol H2O(g),2min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为| △c |
| t |
| △c |
| t |
| ||
| 2min |
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| 0.2×0.2 |
| 0.3×0.8 |
| 0.4 |
| 2 |
| 0.77×2mo1?L&;-1 |
| 4×0.53mo1?L&;-1 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 条件变化 | 平衡移动方向 | n(OH-)的变化 | c(OH-)的变化 |
| ①溶液温度升高5℃ | |||
| ②通入少量氨气 | |||
| ③加水稀释 | |||
| ④加入少量氢氧化钠固体 | |||
| ⑤加入少量氯化铵固体 | |||
| ⑥通入少量二氧化碳气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
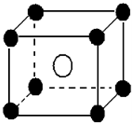 某离子晶体晶胞如图所示,阳离子 X(●)位于立方体的顶点,阴离子Y(○)位于立方体的中心,试分析:
某离子晶体晶胞如图所示,阳离子 X(●)位于立方体的顶点,阴离子Y(○)位于立方体的中心,试分析:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2和O2点燃生成H2O的反应与H2O电解生成H2和O2的反应 |
| B、CuSO4吸水形成晶体蓝矾与蓝矾加热失去水分生成CuSO4 |
| C、Cl2溶于水 |
| D、Na2O溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L |
| B、1 mol臭氧和1.5 mol氧气含有相同的氧原子数 |
| C、浓度均为1 mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1 |
| D、等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com