
| A、FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- |
| B、过量CO2通入氢氧化钠溶液中:CO2+2OH-=CO32-+H2O |
| C、澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-=CaCO3↓+H2O |
| D、AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
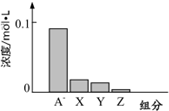 常温下,0.2mol/L 的一元酸 HA 与等浓度的 NaOH 溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示.请回答下列问题:
常温下,0.2mol/L 的一元酸 HA 与等浓度的 NaOH 溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 结构基团,同时符合上述要求的所有同分异构体共有(不考虑立体异构)( )
结构基团,同时符合上述要求的所有同分异构体共有(不考虑立体异构)( )| A、6 | B、9 | C、12 | D、15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝、镓合金与水反应后的物质可以回收利用冶炼铝 |
| B、铝的金属性比镓强 |
| C、铝镓合金的熔点比铝低 |
| D、Ga(OH)3与Al(OH)3性质相似,能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 以葡萄糖为燃料的微生物燃料电池如图所示.关于该电池的叙述正确的是( )
以葡萄糖为燃料的微生物燃料电池如图所示.关于该电池的叙述正确的是( )| A、该电池能够在高温下工作 |
| B、电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+ |
| C、放电过程中,将生成的CO2和水随时排出,保持电解质浓度恒定 |
| D、在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO222.4/6 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有②⑥ |
| B、只有②⑤ |
| C、只有①②⑤⑥ |
| D、只有②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、溶质的质量分数为w=
| ||
B、溶质的物质的量浓度c=
| ||
C、溶液中c(OH-)=
| ||
| D、上述溶液中再加入V mL水后,所得溶液溶质的质量分数等于0.5w |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com