
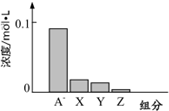
 常温下,0.2mol/L 的一元酸 HA 与等浓度的 NaOH 溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示.请回答下列问题:
常温下,0.2mol/L 的一元酸 HA 与等浓度的 NaOH 溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示.请回答下列问题:

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、食盐中阴离子的结构示意图为: |
| B、蔗糖和醋酸都是弱电解质 |
C、“84消毒液”中有效成分NaClO的电子式为: |
| D、明矾溶液水解可制得Al(OH)3胶体,用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 结晶 |
| 精制 |
| 电解 |
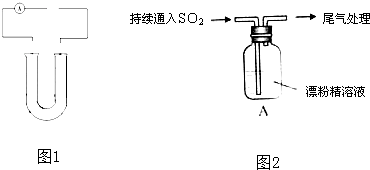
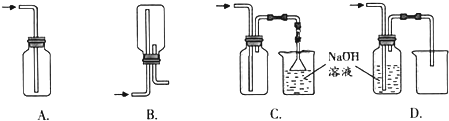
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- |
| B、过量CO2通入氢氧化钠溶液中:CO2+2OH-=CO32-+H2O |
| C、澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-=CaCO3↓+H2O |
| D、AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com