
【题目】生产生活中一时一刻也离不开化学物质。下列常见物质属于硫酸盐的是
A.苏打B.明矾C.铁红D.水玻璃
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产、生活中应用广泛。回答下列问题:
(1)用新制Cu(OH)2与葡萄糖反应可制备Cu2O,该反应中葡萄糖是___________(填“氧化剂”或“还原剂”)。
(2)用H2O2、H2SO4混合溶液浸泡废印刷电路板可制备CuSO4以实现铜的回收利用,其离子方程式为______________________。
(3)用NH4NO3氧化海绵铜(含Cu的CuO)生产CuCl的部分流程如下:
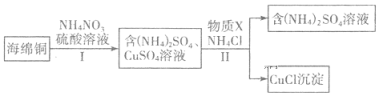
①步骤I中反应温度不宜过高的原因是______,当0.5 mol NH4NO3参加反应时,反应中有4 mol电子发生转移,则铜参加反应的离子方程式为 ______________。
②步骤Ⅱ中物质X可选用____(填字母),该物质需过量的原因,其一是加快反应速率,其二是____________。
a.Cu b.Cl2 c.H2O2 d.(NH4)2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
①增加少量![]() ②升高温度③体积不变,再通入
②升高温度③体积不变,再通入![]() ④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中有Fe3+、Fe2+、Mg2+和Al3+四种离子,若向其中加入过量的Na2O2并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( )
A.Mg2+B.Fe3+C.Fe2+D.Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是最重要的金属之一,铝及其化合物在生活中有广泛的用途。
(1)纳米铝粉可以作高效催化剂、导电膜层、高档金属颜料等。普通铝在空气中能稳定存在,而纳米铝粉在空气中能自燃,从影响反应速率的角度分析其原因是________。
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①该反应的化学方程式为_________________。
②MnO2加入酸化后的H2O2溶液中,MnO2溶解,同时产生无色无味的气体。该反应的离子方程式是_____________,该反应中还原剂是___________。
(3)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O将产生的气体通过下图所示装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O将产生的气体通过下图所示装置。
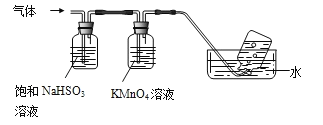
①集气瓶中收集到的气体是_________(填化学式)。
②B中酸性KMnO4溶液褪色(MnO4—还原为Mn2+),发生反应的离子方程式为__________。
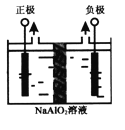
(4)Al(OH)3是重要化工原料。电解法制备高品质Al(OH)3的装置如图(中间用离子交换膜隔开),电解总反应方程式为4NaAlO2+10H2O![]() 4Al(OH)3↓+4NaOH+O2↑+2H2↑,阳极的电极反应式为____________。
4Al(OH)3↓+4NaOH+O2↑+2H2↑,阳极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,使一定量的A和B气体混合发生2A(g)+3B(g)![]() 4C(g)反应。下列描述中,说明反应已达到平衡状态的是
4C(g)反应。下列描述中,说明反应已达到平衡状态的是
A. 各物质的浓度之比c(A)∶c(B)∶c(C)=2∶3∶4
B. 混合气体中各物质的浓度相等
C. 单位时间内,若消耗了a molA物质,同时也消耗了2a mol C物质
D. 混合气体的体积是反应开始前的4/5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”接线柱的说法中正确的是
A.充电时作阳极,放电时作负极B.充电时作阳极,放电时作正极
C.充电时作阴极,放电时作负极D.充电时作阴极,放电时作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结构化学从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质。
(1)下列说法正确的是 ______(填字母)。
A、元素电离能由大到小的顺序:O>N>C
B、一个尿素(CO(NH2)2)分子中含1个π键和7个σ键
C、氯化钠和氯化铯晶体具有相同的晶胞
(2)根据等电子体原理,羰基硫(OCS)分子的电子式应为______。光气(COCl2)分子内各原子最外层都满足8电子稳定结构,则光气分子的空间构型为____(用文字描述)。
(3)Cu2+基态的电子排布式为______。将硫酸铜溶液蒸发浓缩后降温结晶,析出蓝色晶体,取25.0g晶体置于坩埚中在一定温度下灼烧,测得剩余固体质量始终保持为23.2g,进一步升高灼烧温度,固体变为白色且质量为16.0g,已知该晶体属于配合物(配合物的内界结构比较稳定),推测其合理的化学式可以表示为______。
(4)通常情况下,溶液中的Fe3+比Fe2+稳定,理由是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com