
【题目】铜及其化合物在生产、生活中应用广泛。回答下列问题:
(1)用新制Cu(OH)2与葡萄糖反应可制备Cu2O,该反应中葡萄糖是___________(填“氧化剂”或“还原剂”)。
(2)用H2O2、H2SO4混合溶液浸泡废印刷电路板可制备CuSO4以实现铜的回收利用,其离子方程式为______________________。
(3)用NH4NO3氧化海绵铜(含Cu的CuO)生产CuCl的部分流程如下:
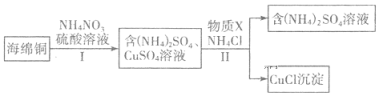
①步骤I中反应温度不宜过高的原因是______,当0.5 mol NH4NO3参加反应时,反应中有4 mol电子发生转移,则铜参加反应的离子方程式为 ______________。
②步骤Ⅱ中物质X可选用____(填字母),该物质需过量的原因,其一是加快反应速率,其二是____________。
a.Cu b.Cl2 c.H2O2 d.(NH4)2SO3
【答案】还原剂Cu+H2O2+2H+=Cu2++2H2O防止生成氮氧化物造成污染4Cu+NO3-+10H+=4Cu2++NH4++3H2Oad防止CuCl被氧化
【解析】
(1)葡萄糖中含有醛基,能够被新制氢氧化铜氧化为羧基,化学方程式为CH2OH(CHOH)4CHO+2Cu(OH)2![]() CH2OH(CHOH)4COOH+Cu2O↓+2H2O,生成葡萄糖酸和Cu2O,Cu元素化合价降低,被还原,为氢氧化铜为氧化剂,葡萄糖为还原剂,被氧化;正确答案:还原剂。
CH2OH(CHOH)4COOH+Cu2O↓+2H2O,生成葡萄糖酸和Cu2O,Cu元素化合价降低,被还原,为氢氧化铜为氧化剂,葡萄糖为还原剂,被氧化;正确答案:还原剂。
(2)铜在酸性条件下,被双氧水氧化为铜离子,双氧水被还原为水,化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,其离子方程式为:Cu+H2O2+2H+=Cu2++2H2O;正确答案:Cu+H2O2+2H+=Cu2++2H2O。
(3)海绵铜加入硫酸酸化的硝酸铵,由于酸性条件下硝酸根离子具有强氧化性,可氧化铜,因硝酸铵易分解,则加热温度不能太高,经步骤Ⅰ得到硫酸铵和硫酸铜溶液,经步骤Ⅱ可得到CuCl,反应中Cu元素被还原,则加入的X应具有还原性,可为铜或亚硫酸铵等还原性物质,注意尽量不要引入新杂质,经过滤可得到CuCl和硫酸铵溶液;
①加热温度不能太高,硝酸根离子可被还原生成氮氧化物,易导致环境污染;0.5molNH4NO3参加反应有4mol电子转移,则N元素被还原为﹣3价,反应的离子方程式为4Cu+NO3﹣+10H+=4Cu2++NH4++3H2O;正确答案:防止生成氮氧化物造成污染;4Cu+NO3-+10H+=4Cu2++NH4++3H2O。
②经步骤Ⅱ可得到CuCl,反应中Cu元素被还原,则加入的X应具有还原性,可为铜或亚硫酸铵等还原性物质,注意尽量不要引入新杂质,ad符合;该物质需过量以防止CuCl被氧化;正确答案:ad;防止CuCl被氧化。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下某溶液中由水电离产生的[H+]=1×10-5mol·L-1,则下列叙述正确的是
A.一定是碱溶液
B.一定是酸溶液
C.由水电离出的[OH-]=1×10-9mol·L-1
D.pH值可能为9也可能为5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(结构简式为![]() )有下列叙述:①不能使酸性KMnO4 溶液褪色;②能使溴的四氯化碳溶液褪色;③不可溶于水;④可溶于苯中;⑤1mol苯乙烯最多能与4molH2发生加成反应;⑥所有的原子不可能共平面,其中正确的是
)有下列叙述:①不能使酸性KMnO4 溶液褪色;②能使溴的四氯化碳溶液褪色;③不可溶于水;④可溶于苯中;⑤1mol苯乙烯最多能与4molH2发生加成反应;⑥所有的原子不可能共平面,其中正确的是
A. ②③④⑤ B. ①②⑤⑥ C. ②③④⑥ D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
A. 反应中硫酸作氧化剂
B. ![]() 中硫元素被氧化
中硫元素被氧化
C. 刺激性气味的气体是氨气
D. 1mol![]() 完全反应转移0.5mol电子
完全反应转移0.5mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高温下,Fe 与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe 与水蒸气反应的实验"。请回答该实验中的问题。

(1)写出该反应的化学方程式__________。
(2)实验前必须对整套装置进行的操作是___________;
(3)在高温条件下铁与水能发生反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。

①实验中使用肥皂液的作用是_____________________________。
②甲同学为探究实验后试管内的固体X中含有哪些物质,进行了下列实验。
实验 编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据上述实验,能确定固体中存在的物质是__________________________;不能确定是否存在FeO的原因是____________________________________。
③如果黑色粉末是Fe3O4,则黑色粉末和盐酸反应得离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧法是测定有机化合物化学式的一种重要方法。在一定温度下取0.1mol某液态烃A在O2中完全燃烧,生成CO2和水蒸汽,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重16.2g,碱石灰增重35.2g。
(1)写出烃A的分子式_______;
(2)含三个甲基的烃A同分异构体的数目为______;
(3)烃A的一种同分异构体,其一氯代物只有一种,写出该同分异构体的结构简式___;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
I.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向I所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤I 中发生反应的化学方程式为___________、___________ 。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因: ___________ 。
(3)步骤Ⅲ获得CuSO4 溶液的离子方程式为___________ 。
(4)步骤II 所得滤液经进一步处理可制得Na2FeO4,流程如下:
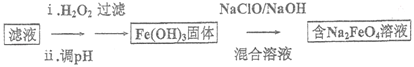
①测得滤液中c(Fe2+)为a mol/L,若要处理1m3滤液,理论上需要消耗25%的H2O2溶液___________kg(用含a 的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式: ___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由X、Y和Z合成缓释药物M,下列说法不正确的是
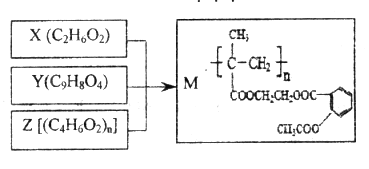
A. M在体内能缓慢发生水解反应
B. X可以由乙烯通过加成反应和取代反应制各
C. 1molY与NaOH溶液反应,最多能消耗3mol NaOH
D. Z由加聚反应制得,其单体的结构简式是CH3CH=CHCOOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com