
| A. | 油脂水解可得到氨基酸 | |
| B. | 蛋白质水解可以得到高级脂肪酸 | |
| C. | 维生素是一类高分子化合物 | |
| D. | 淀粉和纤维素的组成的化学式可表示为(C6H10O5)n,水解最终产物都是葡萄糖 |
分析 A.油脂水解生成高级脂肪酸和甘油;
B.蛋白质水解生成氨基酸;
C.维生素的相对分子质量较小;
D.淀粉和纤维素属于高分子化合物,可水解生成葡萄糖.
解答 解:A.油脂为高级脂肪酸甘油脂,可水解生成高级脂肪酸和甘油,故A错误;
B.蛋白质为氨基酸的缩聚产物,水解生成氨基酸,故B错误;
C.维生素的相对分子质量较小,不是高分子化合物,高分子化合物一般由聚合物,相对分子质量在10000以上,故C错误;
D.淀粉和纤维素属于多糖,为高分子化合物,可水解生成葡萄糖,故D正确.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,难度不大.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:多选题
| A. | 已知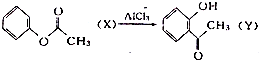 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 | |
| B. | 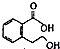 能发生的反应类型:加成反应、取代反应、消去反应、水解反应 能发生的反应类型:加成反应、取代反应、消去反应、水解反应 | |
| C. | 3-甲基-3-乙基戊烷的一氯代物有3种 | |
| D. | 相同条件下乙酸乙酯在水中的溶解度比其在乙醇中的溶解度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):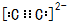 ,基态R原子的价电子排布式为2s22p4.
,基态R原子的价电子排布式为2s22p4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热的温度不同 | B. | 得到的产品不同 | ||
| C. | 前者要隔绝空气,后者不必 | D. | 干馏是化学变化,分馏是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若混合后溶液pH=7,则c(M+)=c(Cl-) | |
| B. | 若b=2a,则c(Cl-)>c(M+)>c(H+)>c(OH-) | |
| C. | 若a=2b,则c(M+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 若混合后溶液满足c(H+)=c(OH-)+c(MOH),则可推出a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Al3+、Cl- | B. | Na+、Al3+、S2-、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、SO42-、HCO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、R、D都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素基态原子第一电离能比B元素基态原子的第一电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D是第Ⅷ族中原子序数最小的元素.
已知A、B、R、D都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素基态原子第一电离能比B元素基态原子的第一电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D是第Ⅷ族中原子序数最小的元素.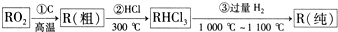
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
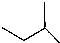 ,下列有关叙述正确的是( )
,下列有关叙述正确的是( )| A. | 该烃的分子式是C5H10 | B. | 与C4H10互为同系物 | ||
| C. | 分子中只有极性共价键 | D. | 能与溴水反应使其褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com