
【题目】下列说法中,正确的是
A. 在任何条件下,1mol任何气体的体积都约是22.4L
B. 化学的特征就是认识分子和制造分子
C. 在化学反应中,反应物的物质的量之和一定等于生成物的物质的量之和。
D. 英国科学家道尔顿提出元素周期律,把化学元素及其化合物纳入一个统一的理论体系。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:还原性强弱:I﹣>Fe2+ . 往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+ . 则原碘化亚铁溶液的物质的量浓度为( )
A.0.12molL﹣1
B.0.1molL﹣1
C.1.2molL﹣1
D.1.0molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池的反应方程式为: 2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2,其构造如图所示。有
关说法不正确的是
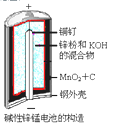
A. 负极反应式:Zn+2OH--2e-=Zn(OH)2
B. 放电时正极MnO2得到电子,发生氧化反应
C. 该电池使用一段时间后,电解液pH增大
D. 放电时,锌粉失去的电子,从负极通过外电路流向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活、航空航天等方面应用广泛。
(1)肼(N2H4)与O2反应的能量变化如图所示。

已知,N—H键、O=O键的键能分别为391kJ/mol、497kJ/mol,则E1=_______kJ/mol,N2H4(g)中N-N键的键能为____________。
(2)某温度下,在1L恒容密闭容器中投入2mol N2H4(g)和lmolN2O4(g),发生反应:
2 N2H4(g)+ N2O4(g)=3N2(g) +4H2O (g) △H=-1097kJ/mol,该反应中 N2以平均反应速率为0.06mol/(L·min)进行10min时达到平衡状态。
①下列叙述能说明反应达到平衡状态的是________。
A.c(N2):c(H2O)=3:4 B.混合气体密度保持不变
C.混合气体平均相对分子质量保持不变 D.混合气体中N2体积分数保持不变
②平衡时,![]() 为________,混合气体总物质的量为_______。
为________,混合气体总物质的量为_______。
③甲、乙是体积相同的恒容密闭容器,起始投入N2H4(g)和N2O4(g)的量相同,甲在恒温条件下达到平衡,乙在绝热条件下达到平衡。平衡时,N2H4(g)的转化率较大的是_____(填 “甲”或“乙”)
(3)如图是反应I:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)和反应Ⅱ:N2(g)+O2(g)=2NO(g)的平衡常数的负对数(pK=-lgK)与温度T的关系。

①根据图中的数据判断,下列说法正确的是_______。
a.反应I为放热反应
b.常温下,反应I的速率很大,二而反应Ⅱ的速率很小
c.升高温度.反应I的速率减小,反应Ⅱ的速率增大
d.x K时,反应I和反应Ⅱ的反应程度相差很大
②下列叙述对反应I自发性判断正确的是_____。
A. 较高温度下能自发进行
B. 较低温度下能自发进行
C. 所有温度下均能自发进行
D. 任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极分别电解下列各物质的溶液:
①CuCl2 ②CuSO4 ③NaBr ④NaNO3 ⑤盐酸 ⑥H2SO4 ⑦KOH
其中只有水被电解的有
A.①②⑤ B.②④⑥⑦ C.④⑥⑦ D.③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的①CH4、②H2、③HCl、④SO2 , 在标况下体积由大到小顺序是( )
A.②>①>③>④
B.④>③>①>②
C.③>②>④>①
D.①>④>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图1实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:


图1 图2
Ⅰ:在试管中加入10mL6mol/L NaOH溶液和2mL 溴乙烷,振荡.
II:将试管如图1固定后,水浴加热.
(1) 写出图1中反应的化学方程式_____________________________________;
(2)为证明溴乙烷在NaOH乙醇溶液中发生的是_________反应(填反应类型),将生成的气体通入如图2装置。A试管中的水的作用是_____________,若无A试管,B试管中的试剂应为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com