
| A、复分解反应一定不是氧化还原反应 |
| B、置换反应一定是氧化还原反应 |
| C、有单质参加的化合反应一定是氧化还原反应 |
| D、没有单质生成的分解反应一定不是氧化还原反应 |
| ||


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
| A、滴入酚酞显红色的溶液:Na+、Mg2+、NO3-、HSO3- |
| B、0.1 mol?L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、Cl- |
| C、0.1 mol?L-1氨水溶液:K+、Na+、NO3-、AlO2- |
| D、由水电离出的c(H+)=10-11mol?L-1的溶液:Ca2+、NH4+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、C的转化率 |
| B、平衡混合气中B的百分含量 |
| C、平衡混合气的平均相对分子质量 |
| D、平衡混合气的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2SO2+O2?2SO3;△H=-196.6 kJ?mol-1 | ||
B、H2 (g)+
| ||
| C、2H2 (g)+O2 (g)=2H2O(l);△H=-571.6 kJ | ||
| D、C(s)+O2 (g)=CO2 (g);△H=+393.5 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学键断裂的过程是吸收能量的过程 |
| B、水分解产生氢气和氧气时放出能量 |
| C、需要加热的反应就是吸热反应 |
| D、并不是所有的化学反应都伴随着能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、①④ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
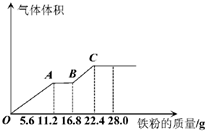 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析错误的是( )| A、AB段的反应为:Fe+2Fe3+=3Fe2+ |
| B、第二份溶液中最终溶质为FeSO4 |
| C、混合酸中NO3-物质的量为0.4mol |
| D、混合酸中H2SO4浓度为5mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50 mL 1 mol?L-1KCl溶液 |
| B、25 mL 2 mol?L-1Ca(Cl)2溶液 |
| C、150 mL 3 mol?L-1KCl溶液 |
| D、50 mL 1 mol?L-1 MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com