
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
| (16.21-1.20)+(18.90-3.00)+(19.49-4.50) |
| 3 |
| 0.0153L×0.08mol/L |
| 2 |
0.404g×
| ||
| 0.6g |


 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
| A、复分解反应一定不是氧化还原反应 |
| B、置换反应一定是氧化还原反应 |
| C、有单质参加的化合反应一定是氧化还原反应 |
| D、没有单质生成的分解反应一定不是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是一种新元素 |
| B、原子核内有185个质子 |
| C、原子核内有185个中子 |
| D、是183Hf的一种新的同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
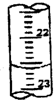 某学生用0.1000mol?L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.1000mol?L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:
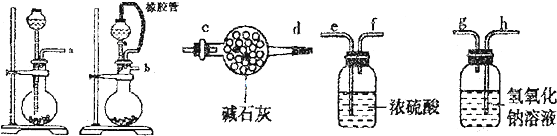
| Cr2O3 |
| 熔点(℃) | 沸点(℃) | |
| SO2 | -72.4 | -10 |
| SO3 | 16.8 | 44.3 |
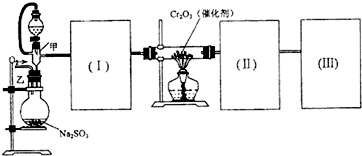
查看答案和解析>>
科目:高中化学 来源: 题型:
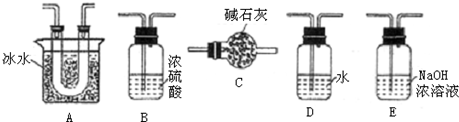
| Cl2 |
| 红磷(少量) |
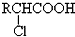 ;
;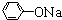 +RCl→NaCl+
+RCl→NaCl+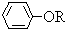
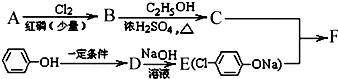
查看答案和解析>>
科目:高中化学 来源: 题型:
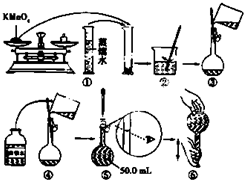
- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、①④ | C、①③ | D、③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com