
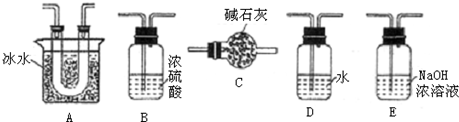
| Cr2O3 |
| 熔点(℃) | 沸点(℃) | |
| SO2 | -72.4 | -10 |
| SO3 | 16.8 | 44.3 |
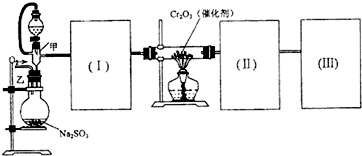
| 25.2g |
| 126g/mol |
| 13.68g |
| 16g/mol |


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
| A、化学键断裂的过程是吸收能量的过程 |
| B、水分解产生氢气和氧气时放出能量 |
| C、需要加热的反应就是吸热反应 |
| D、并不是所有的化学反应都伴随着能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| B、过量的二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO2-=HCO3-+Al(OH)3↓ |
| C、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- |
| D、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、粗盐提纯中除泥沙的操作顺序是:溶解、过滤、蒸发 |
| B、实验室制取氧气完毕后,应先取出集气瓶,再取出导管,最后停止加热 |
| C、蒸馏操作时,冷凝管从上面进水,从下面出水 |
| D、用试管夹夹持试管时,把试管夹从试管底部往上套,夹在试管中上部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
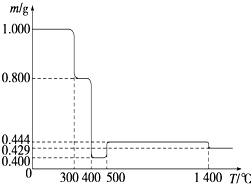 将1.000g FeC2O4?2H2O固体样品放在热重分析仪中进行热重分析,测得其热重分析曲线(样品质量随温度变化的曲线)如图所示:
将1.000g FeC2O4?2H2O固体样品放在热重分析仪中进行热重分析,测得其热重分析曲线(样品质量随温度变化的曲线)如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
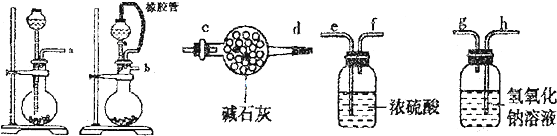
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
查看答案和解析>>
科目:高中化学 来源: 题型:
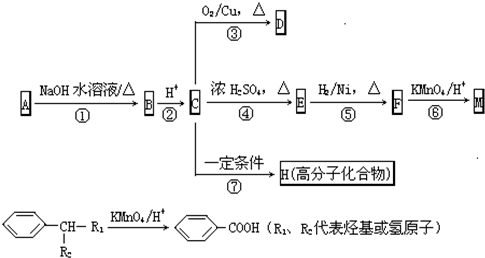
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子外围电子排布为msnmpn+2 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
| F | 基态F+各能层电子全充满 |
查看答案和解析>>
科目:高中化学 来源: 题型:
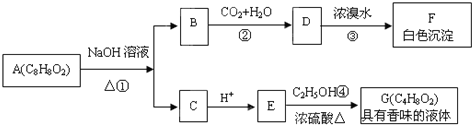
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com