
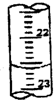
 某学生用0.1000mol?L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.1000mol?L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |
| 20.18ml+20.20ml+20.22ml |
| 3 |
| 500ml |
| 20ml |
| 2.02g |
| 2.5g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、2SO2+O2?2SO3;△H=-196.6 kJ?mol-1 | ||
B、H2 (g)+
| ||
| C、2H2 (g)+O2 (g)=2H2O(l);△H=-571.6 kJ | ||
| D、C(s)+O2 (g)=CO2 (g);△H=+393.5 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50 mL 1 mol?L-1KCl溶液 |
| B、25 mL 2 mol?L-1Ca(Cl)2溶液 |
| C、150 mL 3 mol?L-1KCl溶液 |
| D、50 mL 1 mol?L-1 MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、粗盐提纯中除泥沙的操作顺序是:溶解、过滤、蒸发 |
| B、实验室制取氧气完毕后,应先取出集气瓶,再取出导管,最后停止加热 |
| C、蒸馏操作时,冷凝管从上面进水,从下面出水 |
| D、用试管夹夹持试管时,把试管夹从试管底部往上套,夹在试管中上部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
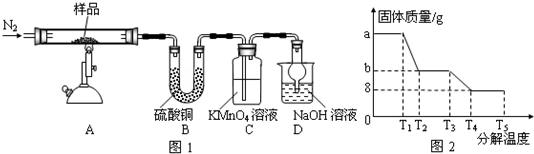
查看答案和解析>>
科目:高中化学 来源: 题型:
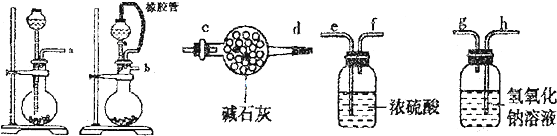
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应 | A | B | C | D |
| △H/kJ?mol-1 | 10.5 | 1.80 | -126 | -11.7 |
| △S/kJ?mol-1?k-1 | 30.0 | -113.0 | 84.0 | -105.0 |
| A、反应A在任何温度下均可自发进行 |
| B、反应B在任何温度下均不可自发进行 |
| C、反应C必须在温度高于170℃时才能自发进行 |
| D、反应D在任何温度下均不可自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | C | |
| B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com