
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:
CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl
据此,某学生设计了下列实验.
【制备NaClO溶液】实验装置如下图左图所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3

(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_______________;Ⅱ中玻璃管a的作用为____________;为了提高NaClO的产率,需对I中产生的Cl2进行净化,所用试剂是________________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________________
【制取水合肼】实验装置如上图右图所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2 H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式____________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品,B装置的名称是______________
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol.L-1 的I2溶液滴定。
已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为____________;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为_____________。
【答案】 BD ![]() 平衡压强 饱和食盐水 防止NaClO分解为NaCl和NaClO3影响水合肼的产率
平衡压强 饱和食盐水 防止NaClO分解为NaCl和NaClO3影响水合肼的产率 ![]() 冷凝管 淀粉溶液 25%
冷凝管 淀粉溶液 25%
【解析】(1)考查溶液的配制,配制一定质量分数的溶液,需要的仪器有烧杯、玻璃棒、天平、量筒,因此缺少的玻璃仪器有烧杯和玻璃棒;(2)本题考查氧化还原反应方程式的书写和物质除杂等知识,装置I是制取Cl2,离子反应方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2HO;II中玻璃管作用是平衡压强;产生的Cl2中混有HCl,HCl和NaOH反应生成NaCl,使NaClO含有杂质增多,因此必须除去HCl,常通过饱和食盐水;根据信息,温度过高,生成的NaClO分解成NaCl和NaClO3,,因此控制温度防止转化生成NaClO3,防止影响水合肼的产率;(3)NaClO具有强氧化性,把N2H4的氮氧化成N2,本身被还原成Cl-,因此有NaClO+N2H4·H2O→N2↑+NaCl+H2O,Cl的化合价降低2价,N的化合价共升高4价,最小公倍数为4,根据原子守恒,配平其他,即2NaClO+N2H4·H2O=N2↑+2NaCl+3H2O;B装置的名称为冷凝管;(4)本题考查滴定实验,①因为有I2参与反应,即指示剂为淀粉,淀粉遇碘单质变蓝;②根据反应方程式,n(N2H4·H2O)=n(I2)/2=20×10-3×0.15/2mol=1.5×10-3mol,其质量为1.5×10-3×50g=0.075g,质量分数为0.075/0.3×100%=25%。
Mn2++Cl2↑+2HO;II中玻璃管作用是平衡压强;产生的Cl2中混有HCl,HCl和NaOH反应生成NaCl,使NaClO含有杂质增多,因此必须除去HCl,常通过饱和食盐水;根据信息,温度过高,生成的NaClO分解成NaCl和NaClO3,,因此控制温度防止转化生成NaClO3,防止影响水合肼的产率;(3)NaClO具有强氧化性,把N2H4的氮氧化成N2,本身被还原成Cl-,因此有NaClO+N2H4·H2O→N2↑+NaCl+H2O,Cl的化合价降低2价,N的化合价共升高4价,最小公倍数为4,根据原子守恒,配平其他,即2NaClO+N2H4·H2O=N2↑+2NaCl+3H2O;B装置的名称为冷凝管;(4)本题考查滴定实验,①因为有I2参与反应,即指示剂为淀粉,淀粉遇碘单质变蓝;②根据反应方程式,n(N2H4·H2O)=n(I2)/2=20×10-3×0.15/2mol=1.5×10-3mol,其质量为1.5×10-3×50g=0.075g,质量分数为0.075/0.3×100%=25%。


科目:高中化学 来源: 题型:
【题目】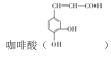 是制备某种抗肿瘤药物的重要原料。由甲苯制备咖啡酸的合成路线(部分反应条件略去)如图所示:
是制备某种抗肿瘤药物的重要原料。由甲苯制备咖啡酸的合成路线(部分反应条件略去)如图所示:

已知:
(1)咖啡酸的分子式为_____,含氧官能团有______。
(2)A的结构简式为_____,该分子的核磁共振氢谱峰面积之比为______。
(3)反应④的化学方程式为________,反应类型为_______。
(4)满足下列条件的咖啡酸的同分异构体有_____种。
①苯环上有三个取代基②1mol该物质能与2molNaHCO3反应。
(5)检验F中碳碳双键官能团的方法是_______。
(6)苯丙烯酸的结构简式为![]() ,根据提供信息ii,设计以甲苯和乙醛为原料制备苯丙烯酸的合成路线。_______
,根据提供信息ii,设计以甲苯和乙醛为原料制备苯丙烯酸的合成路线。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一恒压密闭容器中充入1 mol N2和3 mol H2,在一定条件下发生反应N2+3H2![]() 2NH3 。下列有关说法正确的是:
2NH3 。下列有关说法正确的是:
A. N2完全转化为NH3时,即可视为达到化学平衡状态。
B. 达到化学平衡时,容器内压强和气体密度都不再变化。
C. 达到化学平衡时,反应则停止进行。
D. 达到化学平衡时,3ν(逆NH3)=2ν(正H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某橙汁饮料包装袋上的说明:
品名 | 浓缩橙汁 |
配料 | 水、糖、鲜橙浓缩液、柠檬酸、维生素C、β-胡萝卜素、山梨酸钾等 |
鲜橙原汁含量 | ≥20% |
净含量 | 1.5L |
生产日期 | 标于瓶盖上 |
(1)配料中属于着色剂的是______________。
(2)该橙汁饮料__________(填“含有”或“不含”)防腐剂。
(3)上述各种配料中,国家对__________、_____________的含量进行严格规定加以控制。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A. 平衡移动,K值可能不变 B. 平衡移动,K值一定变化
C. K值不变,平衡可能移动 D. K值变化,平衡一定移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿黑酸症是一种引起酪氨酸在人体内非正常代谢的遗传病,酪氨酸在体内有如下转化:

下列说法错误的是( )
A. 酪氨酸既能与盐酸反应,又能与NaOH溶液反应
B. 1mol尿黑酸与足量浓溴水反应,最多消耗3molBr2
C. 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个
D. 对羟基苯丙酮酸分子核磁共振氢谱有4个峰,有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(s)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 12 mol/(L·min) D.υ(D)= 6 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数的值,则关于热化学方程式C2H2(g)+![]() O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
A.当10NA个电子转移时,该反应吸收1300 kJ的能量
B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量
C.当2NA个碳氧共用电子对生成时,放出1300 kJ的能量
D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浮选凝聚法处理酸性污水的工作原理如图所示,下列说法不正确的是

A. Fe电极的电极反应式为:Fe-2e-═Fe2+
B. 通入空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO32-
C. 通入甲烷的石墨电极的电极反应式为:CH4+100H--8e-═CO32-+7H2O
D. 为增强污水的导电能力,可向污水中加入适量工业用食盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com