
| A. | 1 mol 钠与氧气反应生成 Na2O 或 Na2O2时,失电子数目均为 NA | |
| B. | 1 mol/L 的 NaOH 溶液中含 Na+数目为 NA | |
| C. | 标准状况下,2.24LC6H6 所含的分子数目为 0.1NA | |
| D. | 1 mol Na2O2 中含有的阴离子数目为 2NA |
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-114.6kJ/mol | |
| B. | 由4P(s,红磷)=P4(s,白磷):△H>0可知,白磷的热稳定性比红磷大 | |
| C. | 己知:S(g)+O2(g)=SO2(g);△H1及S(s)+O2(g)=SO2(g):△H2,则△H1<△H2 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
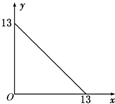 某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:
某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
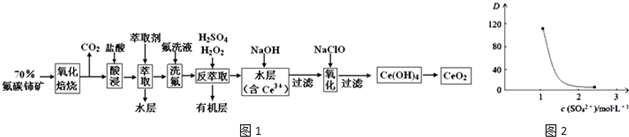
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡ | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
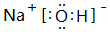 ,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液一定是等体积混合 | B. | 溶液中:c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+) | ||
| C. | 溶液中2c(R2-)+c(HR-)=c(Na+) | D. | 溶液中:c(HR-)>c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可溶性铜盐有毒,故人体内不存在铜元素 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | 宇航服主要成分是由碳化硅陶瓷和碳纤维复合而成,是一种新型无机非金属材料 | |
| D. | 中秋佳节月饼中用小袋包装的铁粉来防止月饼氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
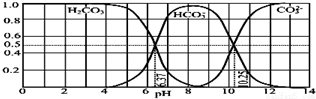
| A. | 此图是 1.0mol•L-1 碳酸钠溶液滴定 1.0mol•L-1 HCl 溶液的滴定曲线 | |
| B. | 在 pH 分别为 6.37 及 10.25 时,溶液中 c(H2CO3)=c(HCO3-)=c(CO32-) | |
| C. | 人体血液的 pH 约为 7.4,则CO2 在血液中多以 HCO3形式存在 | |
| D. | 若用CO2和NaOH反应制取Na2CO3易控制溶液的pH为7~9之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于酯类的有4种 | |
| B. | 属于羧酸的有2种 | |
| C. | 既含有羟基又含有醛基的有3种 | |
| D. | 存在分子中含有六元环的同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com